- Преподавателю
- Физика
- Открытый урок по физике на тему Электролиттердегі электр тогы
Открытый урок по физике на тему Электролиттердегі электр тогы
| Раздел | Физика |
| Класс | 11 класс |
| Тип | Другие методич. материалы |
| Автор | Кулжан С.Б. |
| Дата | 30.01.2016 |
| Формат | rar |
| Изображения | Есть |



 Сабақ жоспары
Сабақ жоспары
Сабақтың тақырыбы: Электролиттердегі электр тогы.
Сабақтың мақсаты: Электролиттердегі электр тогының физикалық табиғатын түсіндіру.
1. Білімділік мәні: білім алушылардың тарау бойынша алған білімдерін жүйелеу, тақырыптық есептер шығару дағдыларын қалыптастыру, талдау жасау, салыстыру қабілеттерін дамыту. Электрондық теория тұрғысында Фарадейдің бірінші және екінші заңын қорытып шығару. Фарадей заңын қолданып есептер шығара білу.
2. Дамытушылық мәні: білім алушыларды өз бетімен ізденуге, білімін шығармашылық тұрғыдан дамытуға, пікір таластырып, ой өрісін кеңейтуге, өз бетімен қорытынды жасауға үйрету.
3. Тәрбиелік мәні: білім алушылардың ғылымға қызығушылығын арттыру, ұжымдылыққа, жауапкершілікке, ізденімпаздыққа тәрбиелеу.
Сабақтың түрі: кіріктірілген сабақ (физика, химия).
Сабақтың әдісі: интерактивті әдіс, сын тұрғысынан ойлау әдісі.
Көрнекілігі: презентация, дидактикалық материалдар.
Құрал-жабдықтар: Компьютер, проектор, интерактивті тақта,
Пәнаралық байланыс: химия.
Сабақтың барысы:
І. Ұйымдастыру бөлімі.
1) Білім алушылармен амандасу;
2) Сабақтың барысын түсіндіру.
ІІ. Үй тапсырмасын тексеру.
-
Сұрақ-жауап.
-
Неліктен барлық металдар - жақсы өткізгіштер?
-
Асқынөткізгіштік деп қандай құбылысты айтады? Оны кім ашты?
-
Жартылай өткізгіштерге қандай заттар жатады?
-
Қандай байланысты коваленттік деп атайды?
-
Меншікті өткізгіштік дегеніміз не?
-
Тест.
1.Жартылай өткізгіштерде зарядты тасымалдаушылар.
А) Теріс иондар;
В) Кемтіктер;
С) Электрондар;
Д) Электрондар мен кемтіктер;
Е) Оң иондар.
2.Транзистордың қанша p-n ауысуы бар?
А) Бір;
В) Үш;
С) Төрт;
Д) Бес;
Е) Екі.
3. Жартылай өткізгіштердің температурасы артқанда кедергісі .
А) Артады;
В) 2 есе артады;
С) Кемиді;
Д) Өзгермейді:
Е) Өзгереді.
4. Жартылай өткізгішті диодтар қандай мақсатта пайдаланылады?
А) Айнымалы токты тұрақты токқа түзету үшін;
В) Тұрақты токты айнымалы токқа айналдыру үшін;
С) Кез-келген электрлік тербелісті күшейту үшін;
Д) Тізбекті токты тұрақты етіп ұстап тұру үшін;
Е) Жартылай өткізгіштің электрондық немесе кемтіктік өткізгіштігін қамтамасыз ету.
5. Транзисторлар қандай мақсатта пайдаланылады?
А) Тізбектегі ток шамасын күшейту үшін;
В) Тізбектегі кернеуді күшейту үшін;
С) Кез -келген электрлік тербелісті күшейту үшін;
Д) Айнымалы токты тұрақты токқа түзету үшін;
Е) Тұрақты кернеуді айнымалы кернеуге айналдыру үшін.
6. Транзистордың неше электроды бар?
А) Үш;
В) Төрт;
С) Бес;
Д) Екі;
Е) Бір.
7. Акцепторлық қоспасы бар жартылай өткізгішті материалдарда электр өткізгіштіктің қандай түрі болады?
А) Электрондық;
В) Кемтіктік;
С) Электрондық және кемтіктік тең шамада;
Д) Ток өткізбейді;
Е) Иондық.
ІІІ. Жаңа сабақ.
Ашылу тарихы.
Электрохимия ғылым ретінде ХVIII және XIX ғасырларда шет елдерде қалыптасты. Тек сол кезде шешімі электрохимия теориясын жаңа дәрежеге көтерген проблемалар туындады. 1799 жылғы итальян физигі А.Вольттің «вольттік бағанасының» - адамзат тарихындағы бірінші ток көзінің пайда болуы және итальян физиологы Л.Гальванидің тәжірибелері электрохимияның ғылым ретінде дамуына бастапқы түрткі болды. Электрохимия жаңа дамып жатқан ғылым. Тек екі ғасыр бұрын электр тогының тұздардың сулы ерітінділері арқылы өткен кезде жаңа заттар пайда болатын химиялық алмасулар жүретіні анықталды. Тек өткен ғасырдың басында ғана заттардың ерітінділері мен балқымаларында болатын электрохимиялық процестерді зерттеудің ғылымдық бағыты - электрохимия пайда болды. Электролиздің өндірістік қолданылуы ХІХ ғасырдың 70 жылдарында тұрақты электр токты қуатты генераторлардың пайда болуынан кейін ғана мүмкін болды.
Электролиттік процестері:
-
Металдардың балқымаларының алынуы;
-
Гальваникалық қабаттардың алынуы;
-
Бейорганикалық заттардың алынуы (хлор, сутегі, оттегі, сілтілер және т.б.);
-
Органикалық заттардың алынуы;
-
Металдардың тазартылуы (қола, күміс);
-
Металдардың алынуы (магний, мырыш, литий, натрий, калий, алюминий және т.б.);
-
Металдар беттерінің өңделуі.
-
Электорофорез көмегімен пленкалардың жабылуы.
-
Электродиализ және судың тұзсыздандыруы.
Электролиздің мақсатты қолданылуы:
Оның көмегімен таза элементтің массалық үлесі жүз пайызға ұмтылатын металдарды алуға болады. Ал натрий, никель, таза сутегі және басқалар тек осы әдіс арқылы алынады. Сондай-ақ мыс пен алюминийді көп жағдайда осы әдіс арқылы алады. Электролиз зергерлік бұйымдарға алтын немесе күміс пленкасымен жабу үшін қолданылады. Осындай әдіспен бұл металдарды коррозиядан қорғайды. Бүгінгі таңда электрохимиялық процестердің зерттелуі, оларға әсер ететін факторларды анықтау, электролиз процессінің өндірістік шараларда қолданудың жаңа түрлерінің анықталуы жүргізіліп жүр. Көптеген факторлар әлі де түсінікіз. Ең басты тапсырма болып, электролиз әдісін одан әрі дамыту, өнімділік пайдалы, ал электроэнергия шығындары минимальды болуы. Сонымен қатар электролиз өнімінің саны мен сапасына әсер ететін түрлі факторларды ескеру қажет (электродтардың материалы, ток тығыздығы, ток күші, электролит температурасы, т.б.).
Электролиз теориясы.
Молекулалардың еріткіштің әрекетінен иондарға ыдырауы электролиттік диссоциация деп аталады.
Ерітілген зат молекулаларының қандай бөлігінің иондарға ыдыраған молекулалар болып табылатынын көрсететін сан диссоциация дәрежесі деп аталады.
Ерітінділердегі зарядтарды тасымалдаушылар иондар болып табылады.
Заряд тасымалдаушылары тек қана иондар болып табылатын сұйық өткізгіш электролит болып табылады.
Электролит арқылы ток өткен кезде электродтарда заттың бөлініп шығу процесі электролиз деп аталады.
Ерітіндідегі оң иондарды катиондар (себебі, олар электролиз кезінде катодқа тартылады) деп, ал теріс иондарды аниондар (олар анодқа тартылады) деп атайды.
Электролиз кезіндегі процестер.
Бірінші жақты өткізгіштер белгілі, оларда электр электрондар арқылы тасымалданады, ал екінші жақты өткізгіштерде электр иондар арқылы тасымалданады.
-
Электрондар иондармен бірінші жақты өткізгіштер екінші жақты өткізгіштермен шектесетін электр тізбегі бар жерлерде өзара әсерлеседі. Сол арқылы электрохимиялық процестер жүреді.
-
Бұл жүйе энергияның химиялық көзі деп аталады, бұл процесстер өздігінен жүреді .
-
Егер олардың жүруі электр энергиясының қосылуымен шартталатын болса, онда электролиз жүреді.
-
Электролиз кезінде электродтарда жүретін электрохимиялық процестер ең алдымен электрохимиялық жүйелерге сәйкес болатын электродтық потенциалдар қатынасына тәуелді болады.
-
Бірнеше мүмкін болатын процестерден минимальді энергия шығыны болатыны жүреді.
-
Бұл катодта ең көп электродты потенциалы болатын электрохимиялық жүйелердің тотықсызданған формаларының тотықтануы жүреді, ал анодта ең аз электродты потенциалы болатын жүйелердің тотықтанған формалары тотықсызданады.
Фарадей заңдары.
Фарадейдің бірінші заңы: «Электролиз кезінде бөлініп шығатын заттың массасы ерітінді арқылы өтетін электр мөлшеріне тура пропорционал».
m=kq
Мұндағы: m - реакцияға түскен заттың мөлшері;
q - электр мөлшері;
k - электр мөлшерінің бірлігіне қанша зат әсер еткенін көрсететін пропорционалдық коэффициент. k мөлшері электрохимиялық эквивалент деп аталады. Өлшем бірлігі - 1 кг/Кл. Мысалы, күміс үшін m=1,118 · 10-6 кг/Кл.
q = It болатындықтан, Фарадейдің бірінші заңын m=kIt деп жазуға болады.
Фарадейдің екінші заңы: «Түрліше заттардың электрохимиялық эквиваленттері олардың химиялық эквиваленттеріне тура пропорционал».
k = 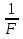 ·
· 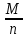
Мұндағы: F - Фарадей тұрақтысы (F = 9,65 · 104 Кл/моль);
М - электродта бөлінген заттың молярлық массасы;
n - ион валенттілігі.
Фарадей тұрақтысы Авогадро тұрақтысы (NA = 6,02 · 1023 моль-1) мен элементар зарядтың (e = 1,6·10-19 Кл) шамаларының көбейтіндісіне тең. Иондардың бір молінің массасының (граммен алынған кезде) бір ионның салыстырмалы молекулалық массасына тең болады: M = Mr · 10-3 кг/моль. Иондардың мольдік массасының олардың валенттілігіне қатынасы 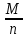 осы иондардың химиялық эквиваленті деп аталады.
осы иондардың химиялық эквиваленті деп аталады.
Фарадейдің электролиз үшін біріккен заңы былай өрнектеледі:
m = 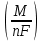 q .
q .
Электролиз процесіне әсер ететін факторлар.
Электролиз эффектілігін келесі факторлар қатарымен баға береді:
-
ток күші,
-
кернеу,
-
ток тығыздығы,
-
ток көзінің ПӘК-і,
-
ток шығыны,
-
зат бойынша шығыны,
-
электр энергиясының ПӘК-і,
-
алынған өнімнің бірлігіне кетірілген электр энергиясының шығыны.
Электролизердегі ток күші мен кернеулік оның өнімділігін сипаттайды. Электролизер арқылы өтетін ток күші неғұрлым көп болса, берілген электролизердің эксплуатациясы кезінде соншалықты көп өнім алуға болады. Жақында қуатты электролизерлердің жасалу тенденциялары байқалуда. Олар ондаған және жүздеген мың амперге саналған (хлор, алюминий және т.б. өнімдері).
ІV. Жаңа ақпарат қабылдау мен тұжырымдауды ұйымдастыру.
Тест.
1. Электролиттерде әр аттас иондардың молекулаға бірігу процесі:
А) иондану;
B) рекомбинация;
C) электролиттік диссоциация;
D) термоэлектрондық эмиссия.
2. Электролиттерде зарядты тасымалдаушы қандай бөлшектер:
А) электрондар мен қемтіктер;
B) электрондар;
C) оң және теріс иондар;
D) оң иондар.
3. Электролиттерде молекуланың әр аттас иондарға ыдырау процесі:
А) иондану;
В) рекомбинация;
С) электролиттік диссоциация;
D) термоэлектрондық эмиссия;
4. Электролиттердегі электр тогы дегеніміз:
А) оң иондардың реттелгенқозғалысы;
B) теріс иондардың реттелген қозғалысы;
C) оң және теріс иондардың қарама-қарсы бағыттағы реттелген қозғалысы;
D) оң және теріс иондардың бір бағыттағы реттелген қозғалысы.
5. Тұздардың, қышқылдардың және сілтілердің ерітінділері, сонымен қоса, тұздар мен металдардың қорытпалары...
А) электродтар;
B) электролиттер;
C) иондар;
D) электрондар.
V . Ақпаратты қайта айту және қолданылатын жаттығулары арқылы іс-әрекеттің түрлерін меңгертуді ұйымдастыру.
№1. Егер бір электронның электрохимиялық эквиваленті белгілі болса, онда оның массасын есептеп шығаруға бола ма (k = 0,0104·10-6 кг/Кл; e = 1,6·10-19 Кл)?
Бер: Шешуі: m= ke.
k = 0,0104·10-6 кг/Кл;
e = 1,6·10-19 Кл. m = 0,0104·10-6 кг/Кл ·1,6·10-19 Кл = 1,664·10-27 кг.
m = ? Жауабы: m = 1,664·10-27 кг.
№2. Қандай да бір электролит арқылы 1 А ток өткен кезде 10 сағат ішінде қанша зат бөлінеді? Ол заттың электрохимиялық эквиваленті k = 0,093·10-6кг/Кл.
Бер: Шешуі: m= kIt.
I = 1A
t = 10 сағ =3600с m = 0,093·10-6 кг/Кл · 1А · 36000с = 3,348·10-6кг.
k = 0,093·10-6кг/Кл
Жауабы: m = 3,348·10-6кг.
m = ?
VІ. Алдында алған білім мен білікке сәйкес білімнің шығармашылық түрде қолданылуы мен меңгерілуін проблемалық тақырыптарды шешу арқылы ұйымдастыру.
І деңгей. Металл заттарды мырышпен қаптау үшін электролиттік ваннаға массасы m = 0,01 кг мырыш электроды батырылған. Электрод толық шығындалу үшін ванна арқылы қандай заряд өту керек. Мырыштың электрохимиялық эквиваленті: k = 3,4 ·10-7 кг /Кл.
А) 5·107 Кл; В) 2,9·104 Кл; С) 4,2·10-7 Кл; Д) 4·10-5 Кл.
ІІ деңгей. 5 сағат ішінде катодта 61,2 гр мырыш бөлініп шығуы үшін ZnSO4 ерітіндісі арқылы қандай ток күшін жіберу керек. Мырыштың электрохимиялық эквиваленті: k = 3,4 · 10-7 кг /Кл.
А) 10А; В) 8А; С) 6А; Д) 5А; Е) 4А.
ІІІ деңгей. Жалпы ауданы 170 см2 металл бұйымды электролиз арқылы 1А ток күші кезінде алтынмен қаптау 2 сағатқа созылды. Алтын қабатының қалыңдығын анықтаңыз. Алтынның тығыздығы ρ = 19300 кг/м3, Электрохимиялық эквиваленті k = 68·10-8 кг /Кл.
А) 0,025 мм; В) 0,023 мм; С) 0,02 мм; Д) 0,17 мм; Е) 0,015мм.
VІІ. Келесі сабаққа үй тапсырмасын беру.
§12.3. Электролиттердегі электр тогы. 23-жаттығу. 1-есеп.
VІІІ. Рефлексия. Сабақты қорытындылау.
-
№
Аты-жөні
Критерий бойынша қойылған ұпай
Ұпай жиынтығы
Бағасы
2.1
2.2
4
5
6
1
2
3
4
 Оңтүстік Қазақстан облысы,
Оңтүстік Қазақстан облысы,
Ордабасы ауданы
№ 18 колледж
Физика пәнінің оқытушысы Құлжан Сәлімбек Балханұлы


