- Преподавателю
- Физика
- Урок «Размеры и масса атомов и молекул»
Урок «Размеры и масса атомов и молекул»
| Раздел | Физика |
| Класс | - |
| Тип | Конспекты |
| Автор | Усенко Е.Г. |
| Дата | 21.02.2014 |
| Формат | doc |
| Изображения | Есть |
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ ГОРОДА МОСКВЫ
Государственное автономное образовательное учреждение
Среднего профессионального образования
ГАОУ СПО Технологический колледж №24
Рассмотрено предметной
цикловой методической комиссией
Протокол № ___ от «__» ______ 20___ г.
Председатель______________________
СОГЛАСОВАНО
Зам.директора колледжа
___________________________
Методическая разработка
урока по теме «Размеры и масса молекул атомов»
Составитель: ___________________ /Е.Г. Усенко/
Конспект урока по теме: «Размеры и масса молекул и атомов».
Преподаватель: Усенко Е.Г.
Предмет: Физика
Группа: 1 курс НПО
Цели урока: дать представление обучающимся о размерах и массах молекул и атомов, научить решать задачи по вычислению основных физических величин молекулярно-кинетической теории, характеристик молекул и атомов; провести контроль знаний по теме.
Задачи:
-
образовательные:
-
дать представление о размерах молекул и атомов;
-
дать понятия электронного микроскопа и область его применения;
-
продолжить формирование умений обучающихся решать задачи на вычисление физических величин;
-
развивающие:
-
развивать память, мышление, внимание обучающихся;
-
развивать умения сравнивать, анализировать, обобщать;
-
воспитательные:
-
-
воспитывать интерес к предмету, положительное отношение к знаниям, ответственность при решении задач.
Тип урока: урок комбинированный при использовании личностно ориентированной технологии (обучение в сотрудничестве, работа малыми группами, дифференцированный подход к обучающимся).
Оборудование для преподавателя: компьютер, проектор, экран, сосуд с водой, пипетка, сосуд с маслом;
для обучающихся: сосуд с водой, крупинки краски, пипетка, периодическая система Д.И.Менделеева, опорные схемы.
План урока
-
Организационный момент 1 минута
-
Подготовка к усвоению нового материала 2 минуты
-
Актуализация опорных знаний 6 минут
-
Освоение нового материала 15 минут
-
Закрепление нового материала 10 минут
-
Первичная проверка полученных знаний 8 минут
-
Домашнее задание 1 минута
-
Подведение итогов урока 2 минуты.
Ход урока
-
Организационный момент.
Озвучивание темы урока Постановка цели урока. Мотивация темы.
-
Подготовка к усвоению нового материала.
Все тела нам кажутся сплошными. Почему?
Можно ли увидеть молекулы в микроскоп? Почему?
Можно ли взвесить молекулу или измерить диаметр молекулы? Почему?
-
Актуализация опорных знаний
Прежде чем изучать новый материал, проведем физический диктант. Как всегда, вы вопрос не записываете, а пишите номер вопроса и ответ коротко и разборчиво.
-
Назовите основные положения молекулярной теории строения вещества.
-
Что изучает молекулярная физика?
-
Одинаковы ли скорости движения всех молекул вещества?
-
Какой энергией обладают молекулы вследствие своего движения?
-
Какой энергией обладают молекулы вследствие взаимодействия друг с другом?
-
Назовите основоположника атомистической теории.
-
Какое движение называется тепловым движением?
Рядом сидящие обучающиеся обмениваются друг с другом своими работами и под диктовку преподавателя карандашом отмечают «плюс» напротив верного ответа. Выставляется оценка. «5» - 7 верных ответов; «4» - 6-5 верных ответов; «3» - 4 верных ответа; «2» - меньше 4 верных ответов. Работы сдаются преподавателю.
-
Освоение нового материала.

Древнегреческие философы Левкипп и его ученик Демокрит еще в 5 в. до н.э. разработали атомистическую теорию, согласно которой в мире существуют лишь атомы («атом» - неделимый), движущиеся в Великой пустоте.
Размеры атомов очень малы (≈0,1нм). Увидеть атомы смогли только в конце 20-го века, т.е. спустя 2500 лет после рождения атомной теории, с помощью электронного микроскопа. Связано это с мощным развитием науки и техники.
электронный микроскоп


кедровая пыльца (увеличение: 80 000)

Эта картина начального состояния роста GaN на сапфире.
Это изображение выглядит как снаряды Tuttle
Увеличение: 20 000
Исследовательская работа №1.
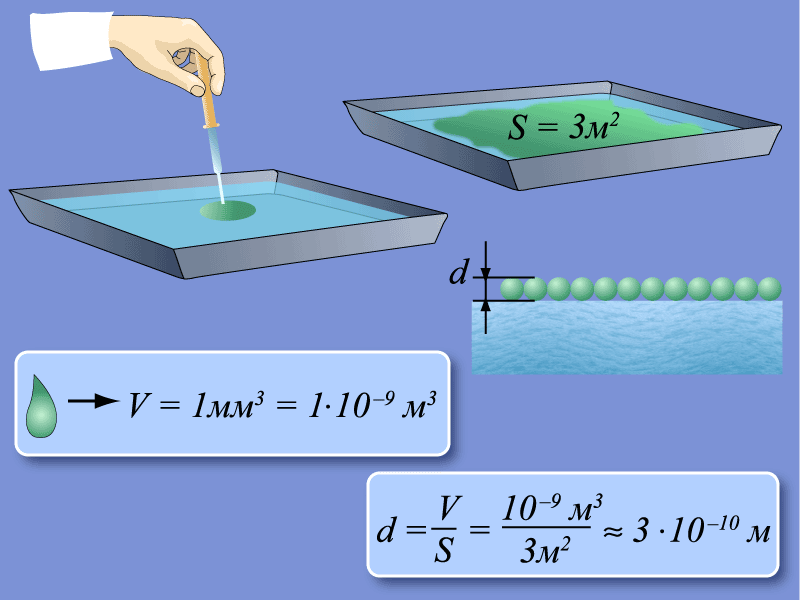
Растворите крупинку краски в небольшом количестве воды. Затем поместите каплю полученного раствора в сосуд с водой, тщательно перемешайте. Отлейте из сосуда половину окрашенной жидкости в другой сосуд, а первый долейте чистой водой до того же уровня. Повторите эту операцию 2-3 раза. В конце опыта оцените окрас жидкости в первом сосуде и сделайте соответствующий вывод о размерах частиц краски.
Для сравнения: в чайной ложке воды содержится примерно столько же молекул воды, сколько чайных ложек воды в мировом океане.
Атом - наименьшая частица данного химического элемента.
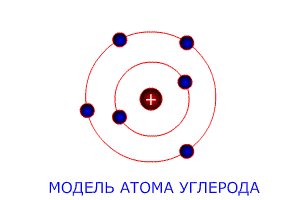 модель атома углерода С
модель атома углерода С
Молекула - это наименьшая устойчивая частица данного вещества, обладающая его основными химическими свойствами.
В капле воды массой 1 г (V=1см3) при диаметре молекулы воды 3. 10 - 8 см содержится:
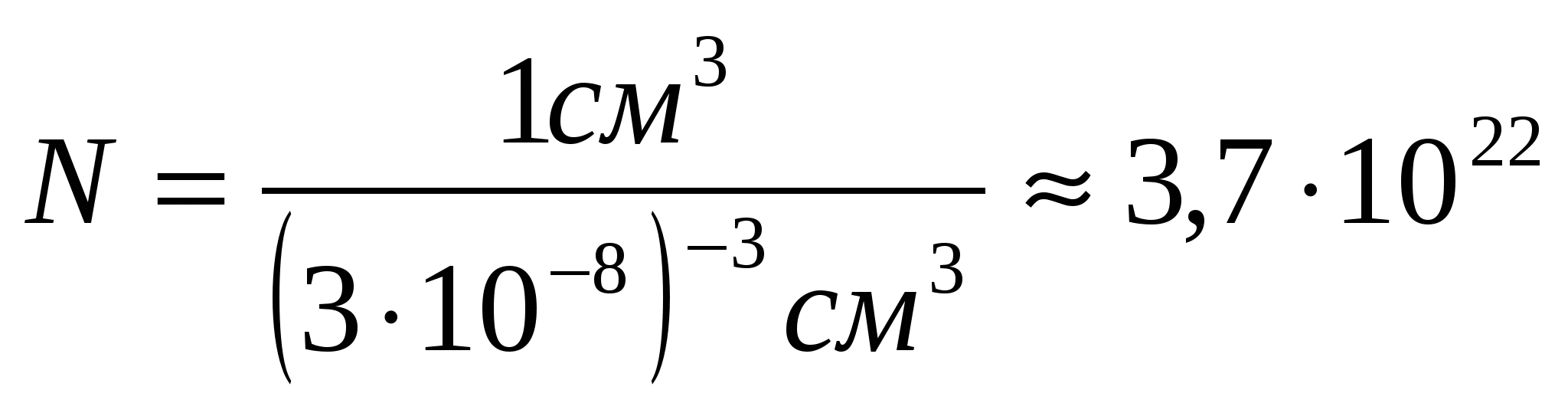 молекул.
молекул.
Масса одной молекулы воды (Н2О):
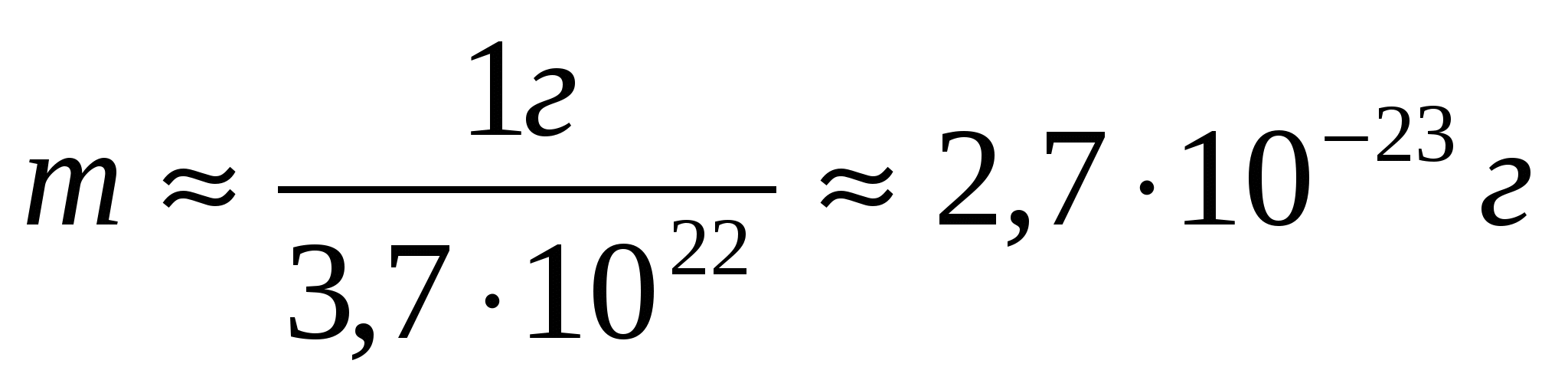
Массы молекул очень малы, поэтому удобно при расчетах использовать не абсолютные значения масс, а относительные. По международному соглашению массы всех атомов и молекул сравнивают с 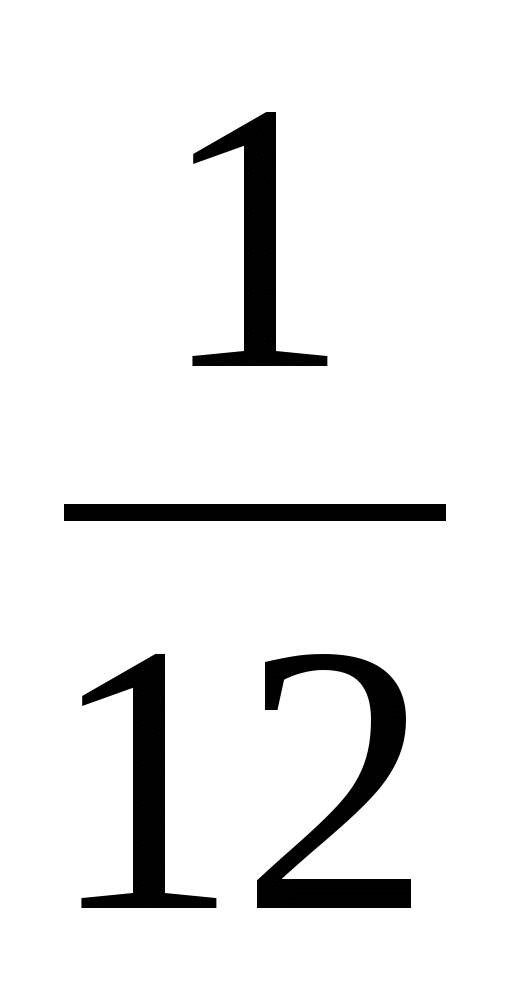 массы атома углерода.
массы атома углерода.
Относительной молекулярной (или атомной) массой вещества Мrназывают отношение массы молекулы (или атома) m0данного вещества к 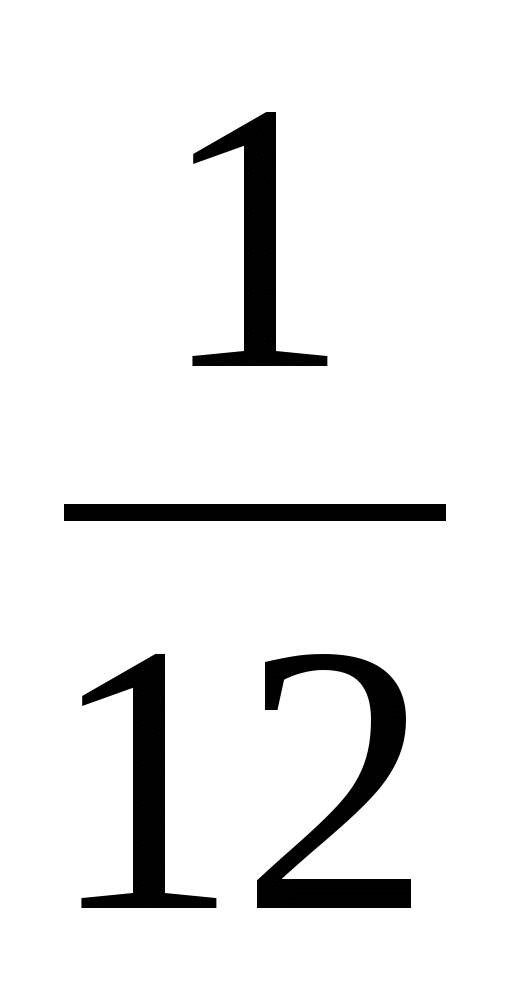 массы атома углерода.
массы атома углерода.
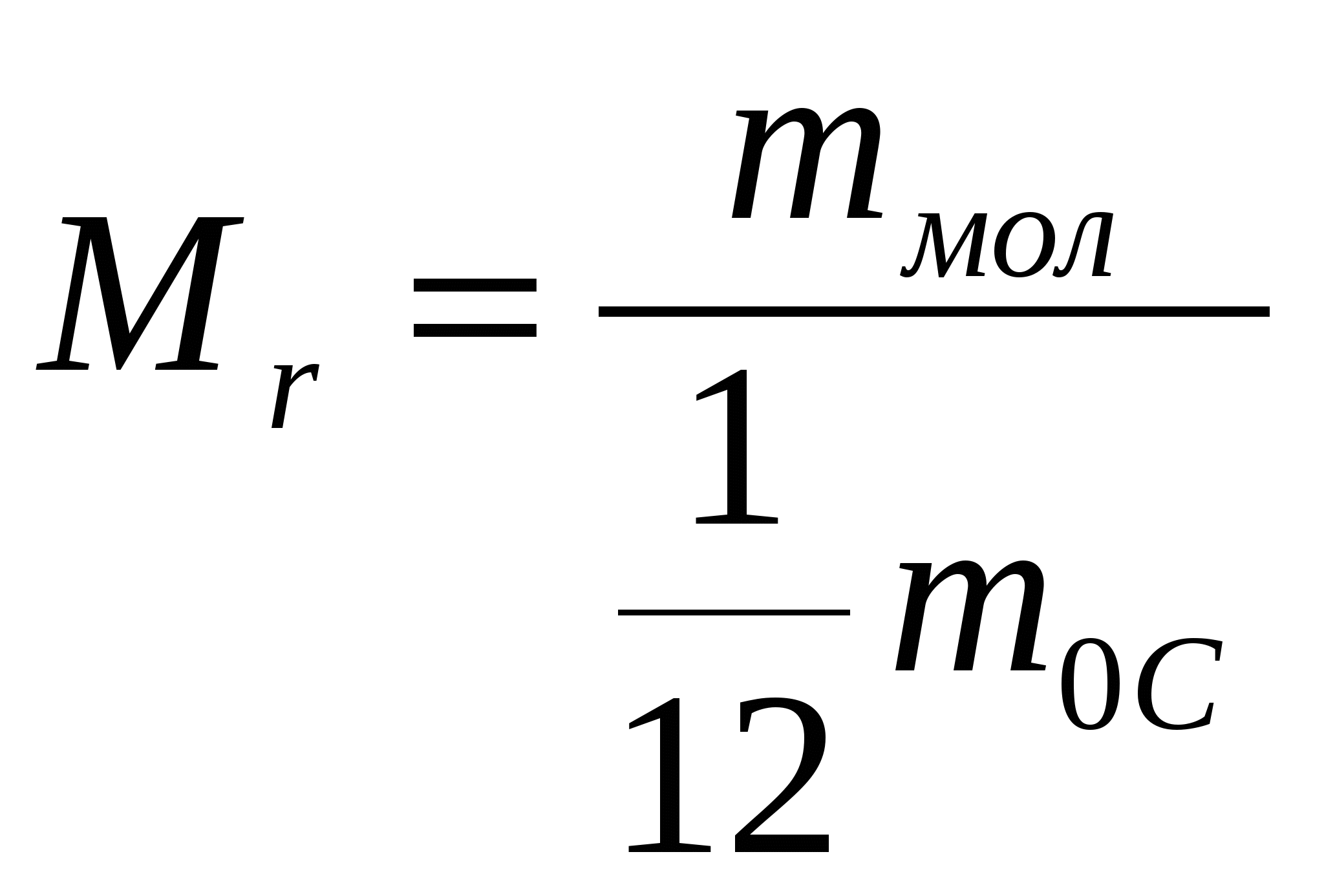 или
или 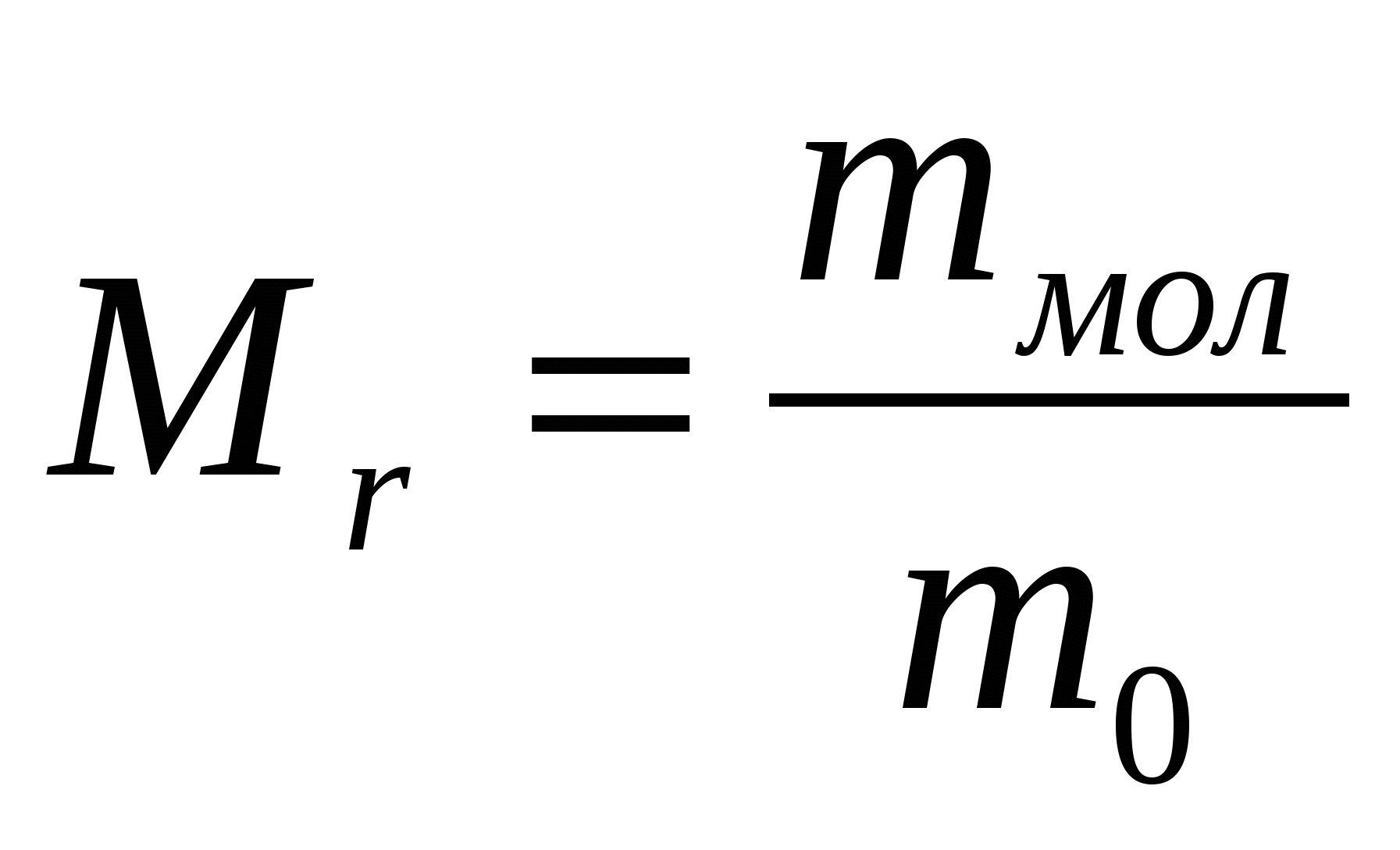 , (1)
, (1)
где m0 = 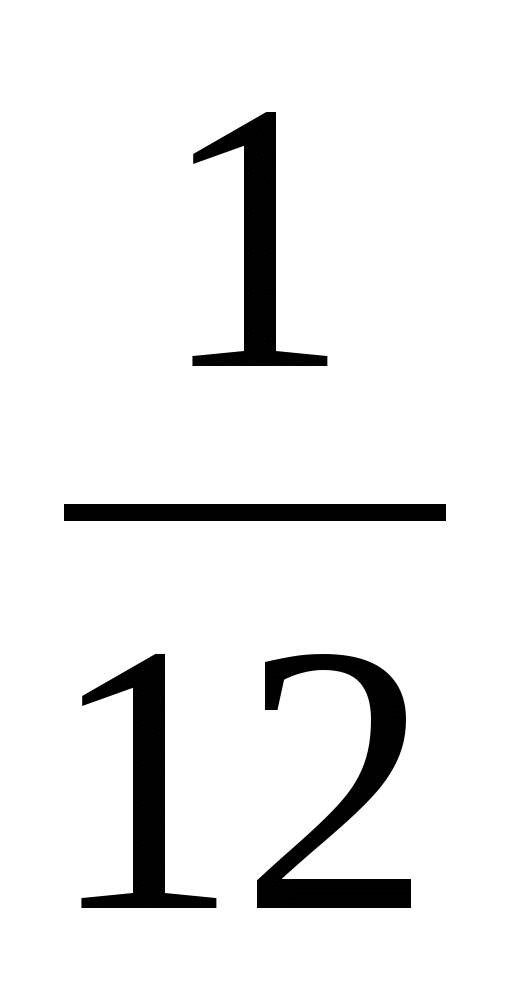 m0c= 1,66 . 10 -27кг = 1а.е.м.- атомная единица массы.
m0c= 1,66 . 10 -27кг = 1а.е.м.- атомная единица массы.
Относительные атомные массы всех химических элементов точно измерены.
Относительная молекулярная масса углекислого газа СО2 приближенно равна 44=12+2.16.
Количество молекул в любом макроскопическом теле велико, поэтому в расчетах используют не абсолютное число молекул, а относительное.
В Международной системе единиц (СИ) количество вещества выражают в молях.
Один моль - это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.
В 1 моле любого вещества содержится одно и то же число атомов или молекул.
Это число - постоянная Авогадро NA ≈ 6,02 . 10 23 моль-1
Количество вещества ν равно отношению числа молекул N в данном теле к постоянной Авогадро NА, т. е. к числу молекул в 1 моль вещества:
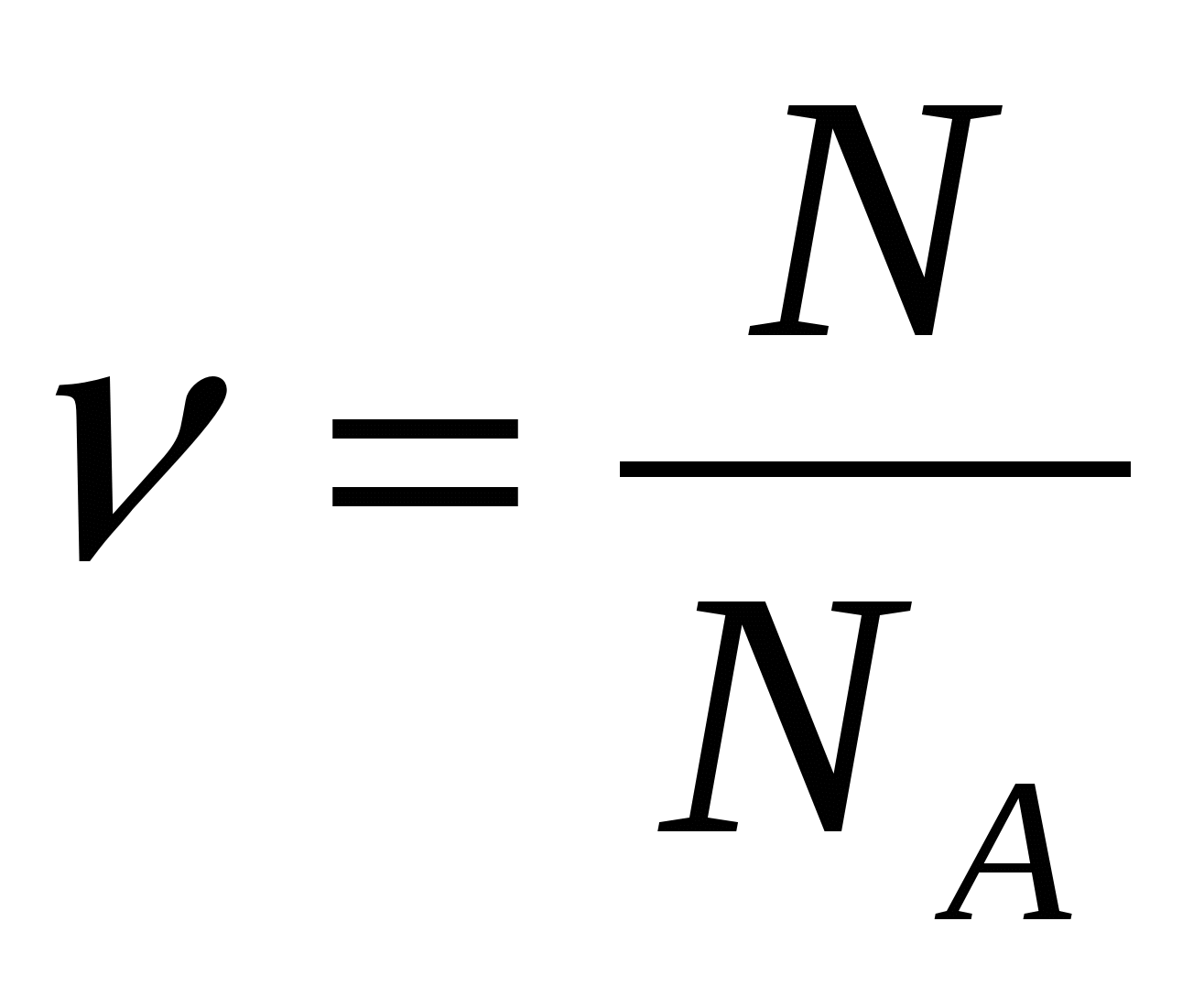 (2)
(2)
Молярной массой М вещества называют массу вещества, взятого в количестве 1 моль, выражается в килограммах на моль (кг/моль)
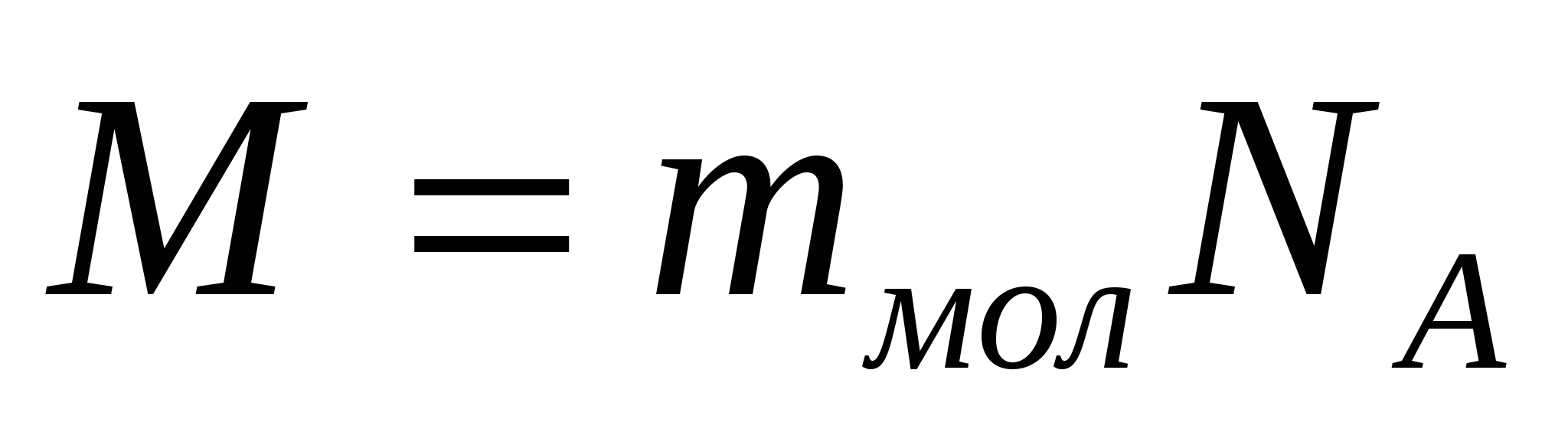 (3)
(3)
Масса любого вещества: 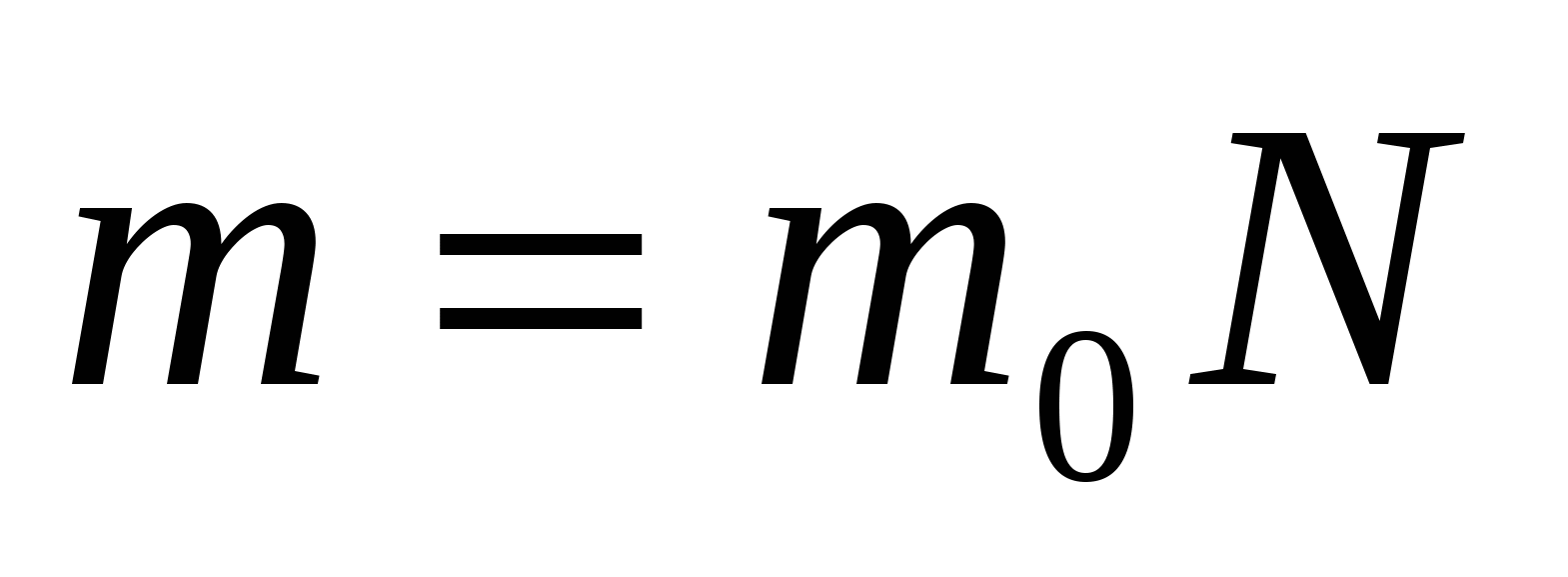 , (4)
, (4)
где 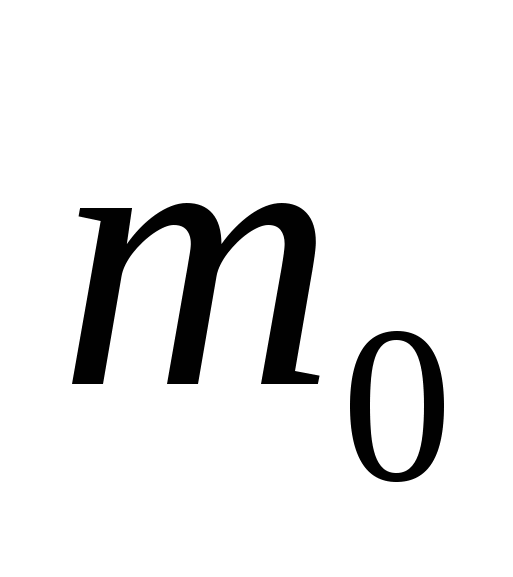 - масса одной молекулы
- масса одной молекулы
N - число молекул в теле.
Заменив величины N и NА в формуле (2) их выражениями из (3) и (4), получим для количества вещества:
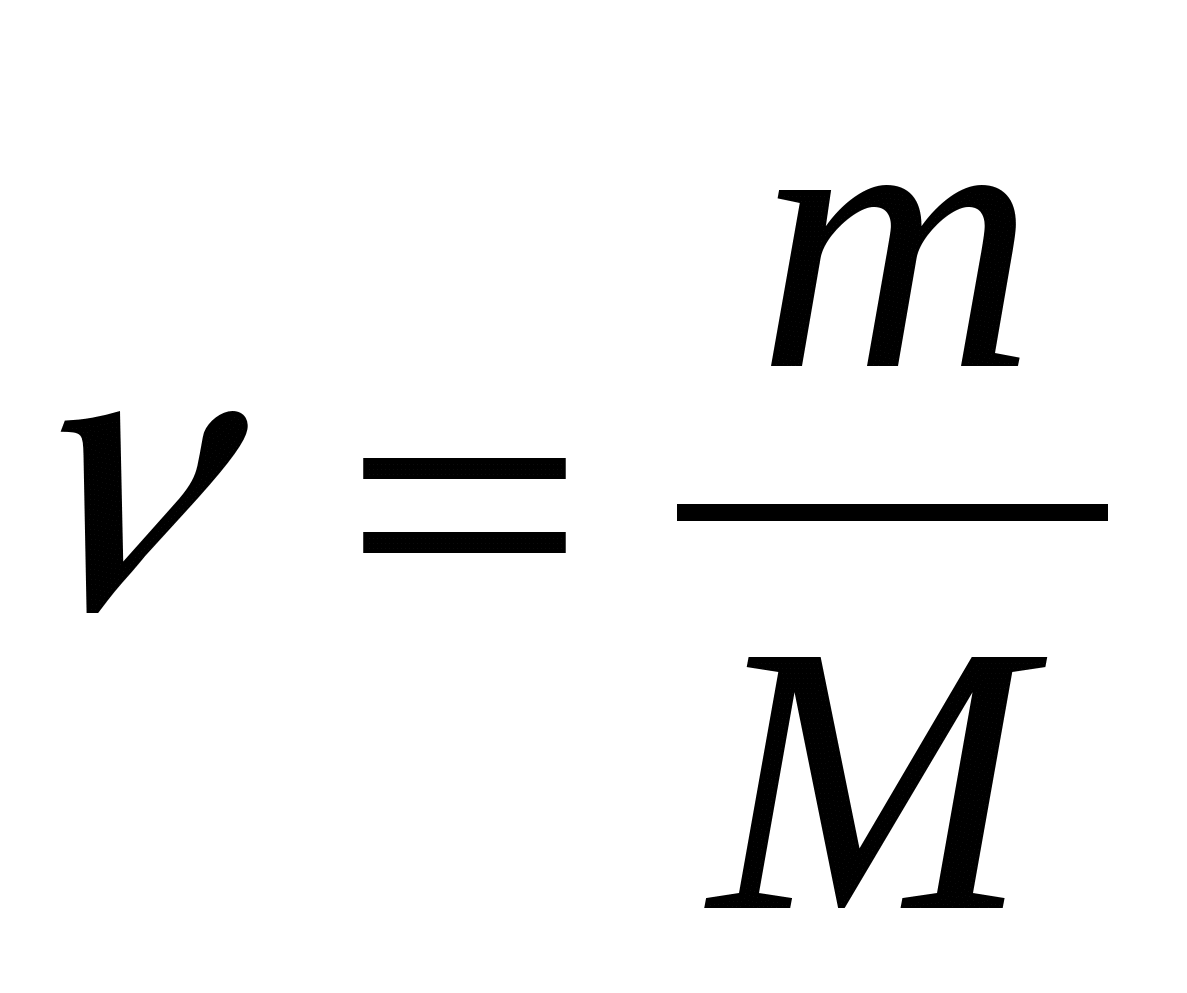 (5)
(5)
Число молекул любого количества вещества массой m и молярной массой М согласно вышеприведенным формулам равно:
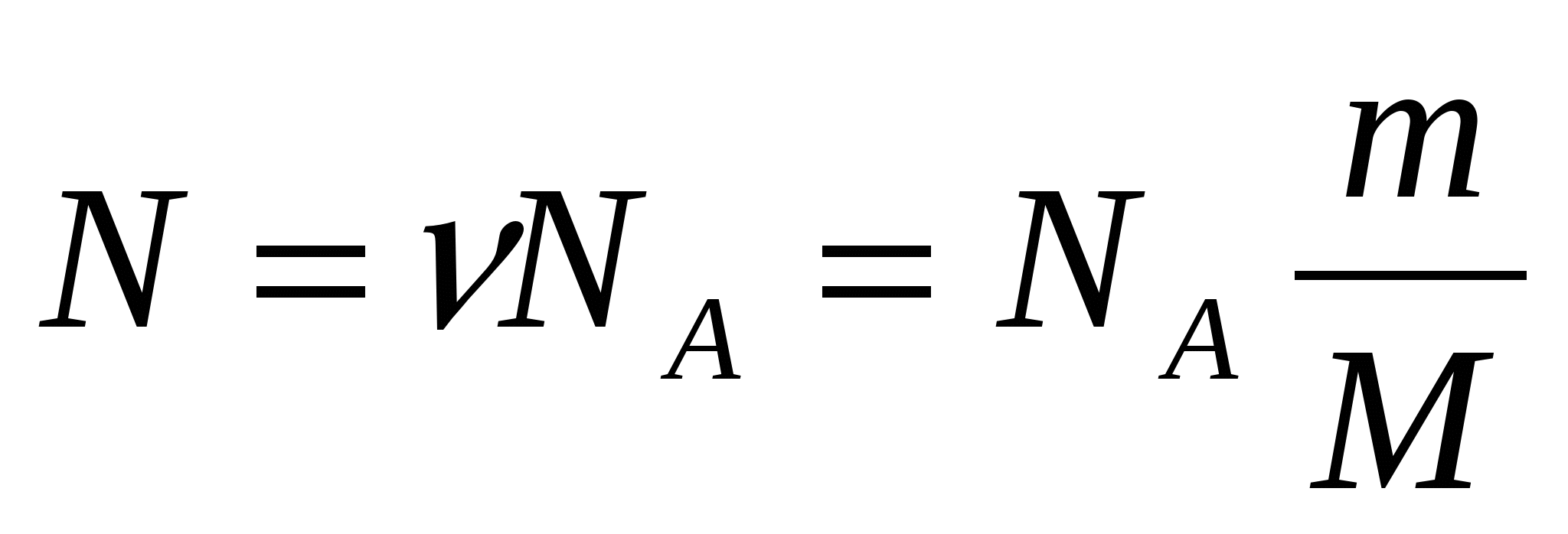 (6)
(6)
Постоянная Лошмидта - это число молекул в 1 м3 любого газа при нормальных условиях:
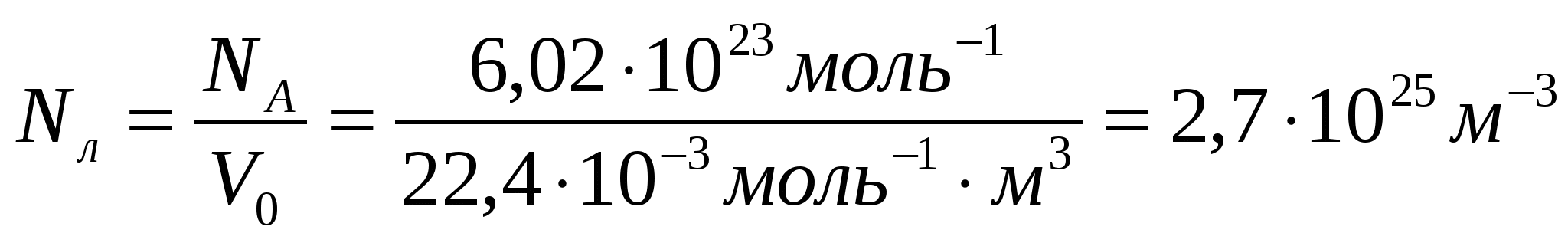 ,
,
где NA ≈ 6,02 . 10 23 моль-1 - постоянная Авогадро
V0 = 22,4 . 10 -3 моль-1 . м-3 - объем 1 моля любого газа при нормальных условиях
Вспомним алгоритм решения задач.
Рассмотрим задачу:
-
Какое количество вещества содержится в серебряном образце массой 0,432 кг?
Проговариваем алгоритм решения данной задачи. Далее преподаватель записывает решение задачи на доске.
-
Какова масса 250 молей метана СН4?
Проговариваем алгоритм решения данной задачи. Далее обучающийся записывает решение задачи на доске.
-
Рассчитайте массу молекулы кислорода.
Проговариваем алгоритм решения данной задачи. Далее обучающийся записывает решение задачи на доске.
-
Закрепление нового материала
Обучающиеся далее работают малыми группами (по 4 человека), имея возможность общаться между собой в ходе обсуждения задач, а также имея возможность подойти с вопросами к преподавателю. Как правило, «в споре рождается истина».
-
Первичная проверка полученных знаний.
-
Единица измерения количества вещества.
-
Определение молярной массы.
-
Обозначение количества вещества и количества молекул.
-
Что называют постоянной Авогадро?
-
Найдите относительную молекулярную массу Н2SО4.
-
Рассчитайте число атомов в золотом предмете массой 500 г.
-
Осуществляется самопроверка карандашом, работы сдаются преподавателю.
-
Домашнее задание: п.4.2, используя учебник и рабочую тетрадь, составить таблицу изученных физических величин по образцу:
Название
Обозначение
Наименование
Расчетная формула
Молярная масса
Масса молекулы
Каждый из обучающихся выбирает уровень заданий на дом (уровень А, В или С)
Уровень А
-
Найдите относительную молекулярную массу соляной кислоты НCl, метана СН4.
-
Напишите о количестве вещества по плану:
-
Что характеризует данная величина?
-
Каково определение количества вещества?
-
Какова формула для расчета? Какие величины она связывает?
-
В каких единицах выражается эта величина?
-
Что означает утверждение: «количество вещества равно 5 моль»?
Уровень В
-
Найдите относительную молекулярную массу оксида железа Fe2O3, борной кислоты Н3ВО3, бензола С6Н6.
-
Рассчитайте число молекул, содержащихся в 1 г калия.
-
Рассчитайте массу 6 ∙1023 молекул кремния.
Уровень С
-
Рассчитайте число атомов в золотом предмете массой 500 г.
-
Сколько молекул содержится в 3 м3 свинца? Плотность свинца 11300 кг/м3.
-
Сравните число атомов, из которых состоят серебряная и алюминиевая ложки равного объёма. Плотность серебра 10,5∙103 кг /м3 , а алюминия 2,7∙103 кг /м3 .
-
Поместятся ли в трехлитровой банке 50 моль ртути?
-
Подведение итогов урока.
Обучающиеся самостоятельно оценивают работу в группе. Преподаватель выставляет общую оценку в журнал с учетом и проверочной работы, и работы в группе.
Преподаватель благодарит обучающихся за слаженную работу на уроке.
Приложение
Опорный конспект
Тема урока ___________________________________________________________________
Цель урока____________________________________________________________________
Физический диктант
-
Назовите основные положения молекулярной теории строения вещества.
-
Что изучает молекулярная физика?
-
Одинаковы ли скорости движения всех молекул вещества?
-
Какой энергией обладают молекулы вследствие своего движения?
-
Какой энергией обладают молекулы вследствие взаимодействия друг с другом?
-
Назовите основоположника атомистической теории.
-
Какое движение называется тепловым движением?
В капле воды массой 1 г (V=1см3) при диаметре молекулы воды 3. 10 - 8 см содержится:
________________________ молекул.
Масса одной молекулы воды (Н2О): ______________________________
Относительной молекулярной (или атомной) массой вещества Мrназывают______________________________________________________________________
Один моль -___________________________________________________________________
Постоянная Авогадро NA___________________________________________________________________________________
Молярной массой М вещества называют_________________________________________
Масса любого вещества________________________________________________________
Формула для количества вещества: ______________________________________________
Число молекул любого количества вещества массой m и молярной массой М согласно вышеприведенным формулам равно: _____________________________________________
Решение задач.
-
Какое количество вещества содержится в серебряном образце массой 0,432 кг?
-
Какова масса 250 молей метана СН4?
-
Рассчитайте массу молекулы кислорода.
Проверка знаний.
-
Единица измерения количества вещества.
-
Определение молярной массы.
-
Обозначение количества вещества и количества молекул.
-
Что называют постоянной Авогадро?
-
Найдите относительную молекулярную массу Н2SО4.
-
Рассчитайте число атомов в золотом предмете массой 500 г.
Домашнее задание.
Название
Обозначение
Наименование
Расчетная формула
Молярная масса
Масса молекулы
Каждый из обучающихся выбирает уровень заданий на дом (уровень А, В или С)
Уровень А
-
Найдите относительную молекулярную массу соляной кислоты НCl, метана СН4.
-
Напишите о количестве вещества по плану:
-
Что характеризует данная величина?
-
Каково определение количества вещества?
-
Какова формула для расчета? Какие величины она связывает?
-
В каких единицах выражается эта величина?
-
Что означает утверждение: «количество вещества равно 5 моль»?
Уровень В
-
Найдите относительную молекулярную массу оксида железа Fe2O3, борной кислоты Н3ВО3, бензола С6Н6.
-
Рассчитайте число молекул, содержащихся в 1 г калия.
-
Рассчитайте массу 6 ∙1023 молекул кремния.
Уровень С
-
Рассчитайте число атомов в золотом предмете массой 500 г.
-
Сколько молекул содержится в 3 м3 свинца? Плотность свинца 11300 кг/м3.
-
Сравните число атомов, из которых состоят серебряная и алюминиевая ложки равного объёма. Плотность серебра 10,5∙103 кг /м3 , а алюминия 2,7∙103 кг /м3 .
-
Поместятся ли в трехлитровой банке 50 моль ртути?


