- Преподавателю
- Физика
- Методическое пособие по физике Молекулярная физика и термодинамика
Методическое пособие по физике Молекулярная физика и термодинамика
| Раздел | Физика |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Миронова А.А. |
| Дата | 09.10.2014 |
| Формат | doc |
| Изображения | Есть |
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Данное методическое пособие предназначено для самостоятельной работы студентов первого курса очного отделения, обучающихся по специальностям 190604 «Техническое обслуживание и ремонт автомобильного транспорта» и 150411 «Монтаж и техническая эксплуатация промышленного оборудования».
Пособие целесообразно использовать при изучении раздела «Молекулярная физика и термодинамика», при подготовке к контрольной работе, а также при подготовке к экзамену.
В данном методическом пособии приведены определения основных физических понятий и величин, изучаемых в разделе «Молекулярная физика и термодинамика», сформулированы физические законы, кратко разъяснена сущность описываемых ими явлений. Приведены примеры решения задач. Единицы физических величин системы единиц приведены в таблице 2.
ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
-
Все тела состоят из мельчайших частиц- атомов, молекул, в состав которых входят ещё более мелкие элементарные частицы (электроны, протоны, нейтроны).Строение любого вещества прерывисто.
-
Атомы и молекулы вещества всегда находятся в непрерывном хаотическом движении.
-
Между частицами любого вещества существуют силы взаимодействия- притяжения и отталкивания. Природа этих сил электромагнитная.
ОСНОВНЫЕ ПОНЯТИЯ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДОНАМИКИ
-
Атом - наименьшая частица данного химического элемента.
-
Молекула - наименьшая устойчивая частица данного вещества, обладающая его основными химическими свойствами
3. Количество вещества - это отношение числа молекул N в данном макроскопическом теле к числу Na атомов в 0,012 кг углерода.
4. Моль - количества вещества, содержащего столько же молекул, сколько содержится молекул в 0,012 кг углерода.
5. Молярная масса вещества - масса вещества, взятого в количестве одного моля.
6. Идеальный газ - газ, для которого можно пренебречь размерами молекул и силами молекулярного взаимодействия.
7. Давление - это физическая величина, равная отношению силы F, действующей на элемент поверхности нормально к ней, к площади S этого элемента.
8. Концентрация - число молекул в единице объёма
9. Тепловое равновесие - состояние системы тел, при котором теплообмен между телами системы отсутствует.
10. Абсолютный нуль - это температура, при которой давление идеального газа отсутствует
11. Теплообмен - процесс передачи энергии от одного тела другому без совершения работы
12. Количество теплоты - энергия, переданная системе или полученная системой при теплообмене
13. Адиабатный процесс - процесс, протекающий в системе, которая не обменивается теплотой с окружающими телами.
14. Изопроцесс - переход данной массы газа из одного состояния в другое при дном постоянном параметре.
15. Изотермический процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре
16. Изобарный процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении.
17. изохорный процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянном объёме.
18. Тепловой двигатель - устройство, которое превращает внутреннюю энергию вещества в механическую.
ОСНОВНЫЕ ЗАКОНЫ МКТ И ТЕРМОДИНАМИКИ
Закон Бойля - Мариотта: для данной массы газа произведение давления на объём постоянно, если температура газа не меняется
P 1V 1=P 2V 2
, где P1 и P2 - давление газа в начальном и конечном состояниях
V1 и V2 - объём газа в начальном и конечном состояниях
Закон Гей - Люссака: для данной массы газа отношение объёма к температуре постоянно, если давление газа не меняется.
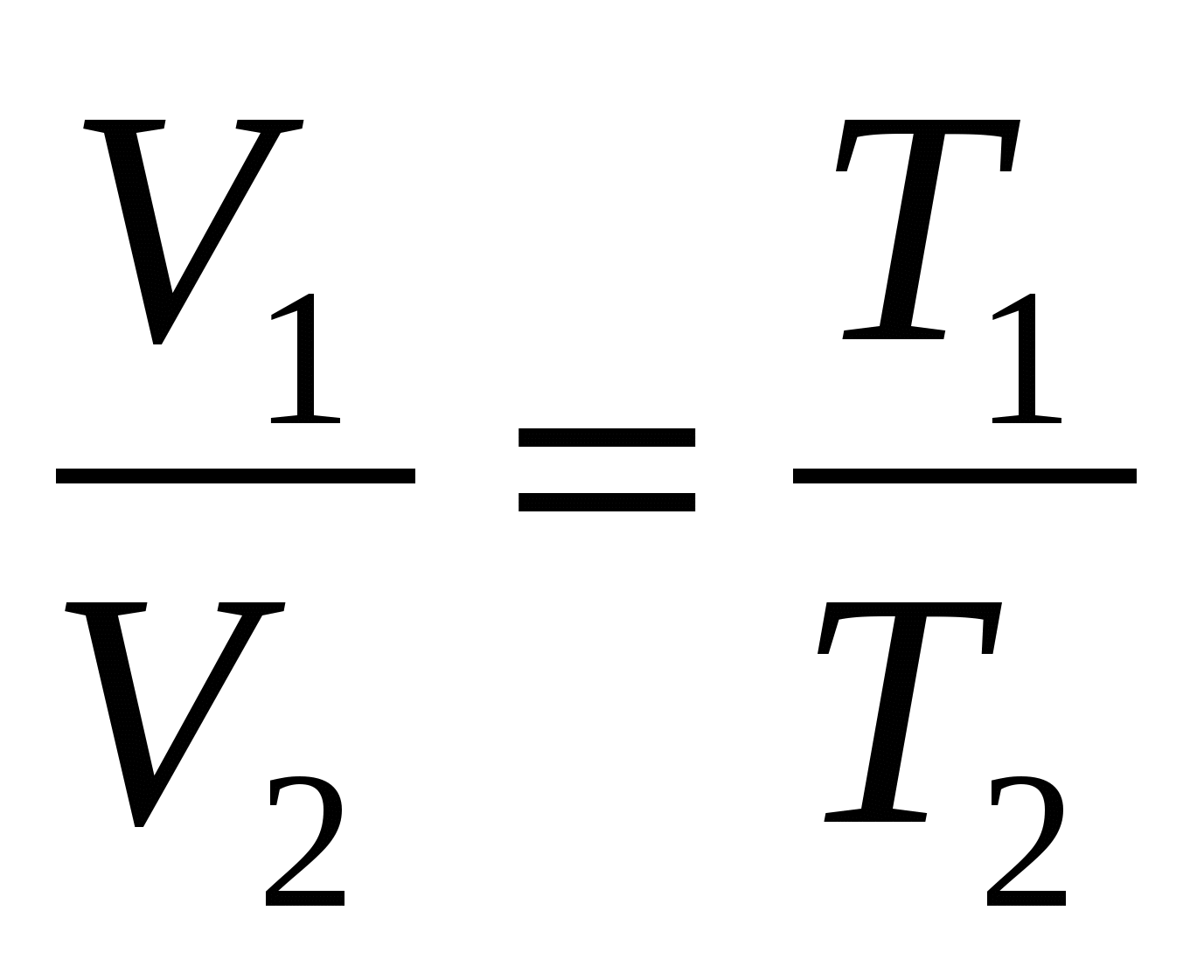
, где V1 и V2 - объём газа в начальном и конечном состояниях
T1 и T2 - температура газа в начальном и конечном состояниях
Закон Шарля: для данной массы газа отношение давления к температуре постоянно, если объём газа не меняется.
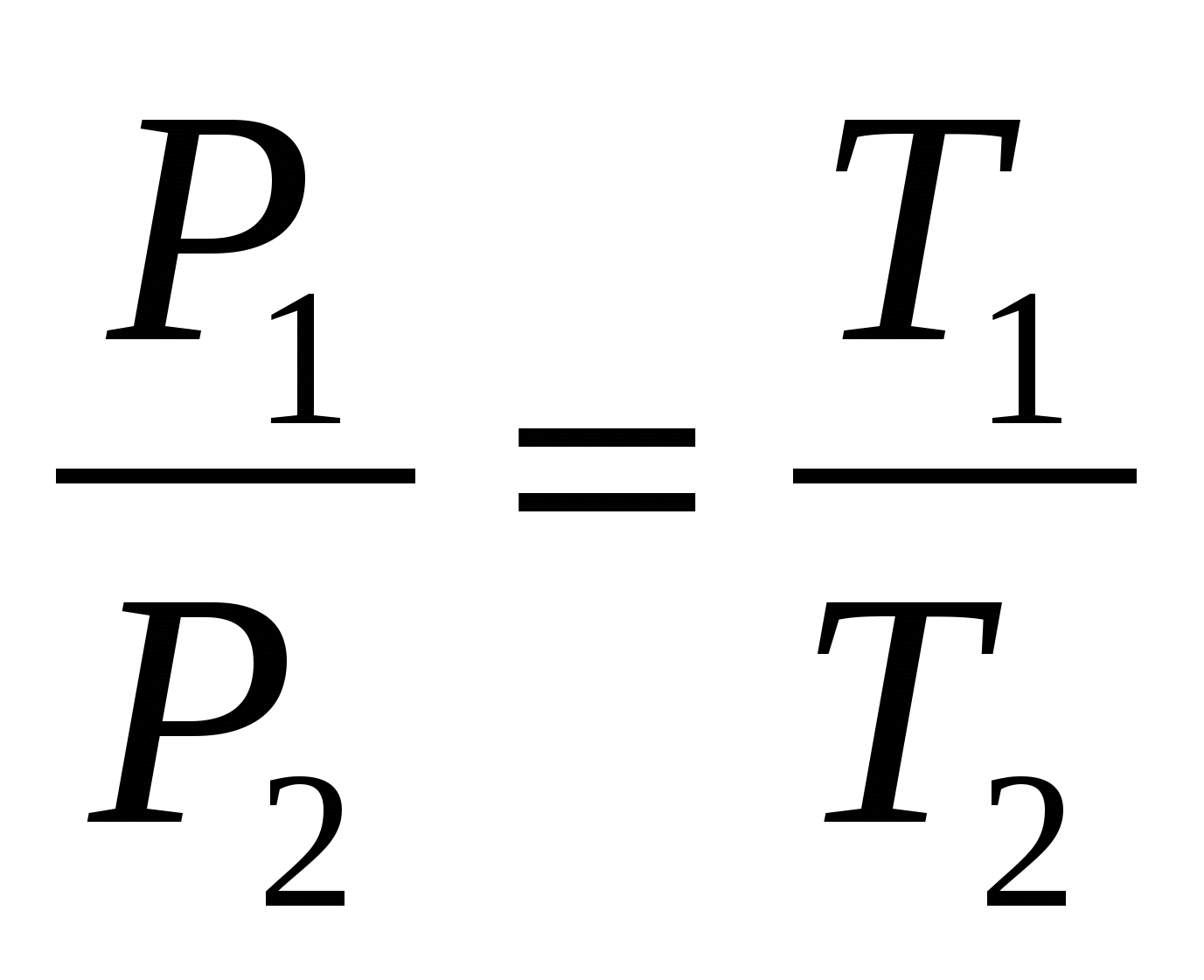
P1 и P2 - давление газа в начальном и конечном состояниях
, где T1 и T2 - температура газа в начальном и конечном состояниях
П
Q=ΔU+Aервый закон термодинамики: Количество теплоты, сообщенное телу, идёт на увеличение его внутренней энергии и на совершение телом работы над внешними телами.
, где Q - количество теплоты
ΔU - изменение внутренней энергии
А - работа над внешними телами
Второй закон термодинамики: невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или в окружающих системах.
ОСНОВНЫЕ УРАВНЕНИЯ МКТ И ТЕРМОДИНАМИКИ
1. Основное уравнение МКТ идеального газа
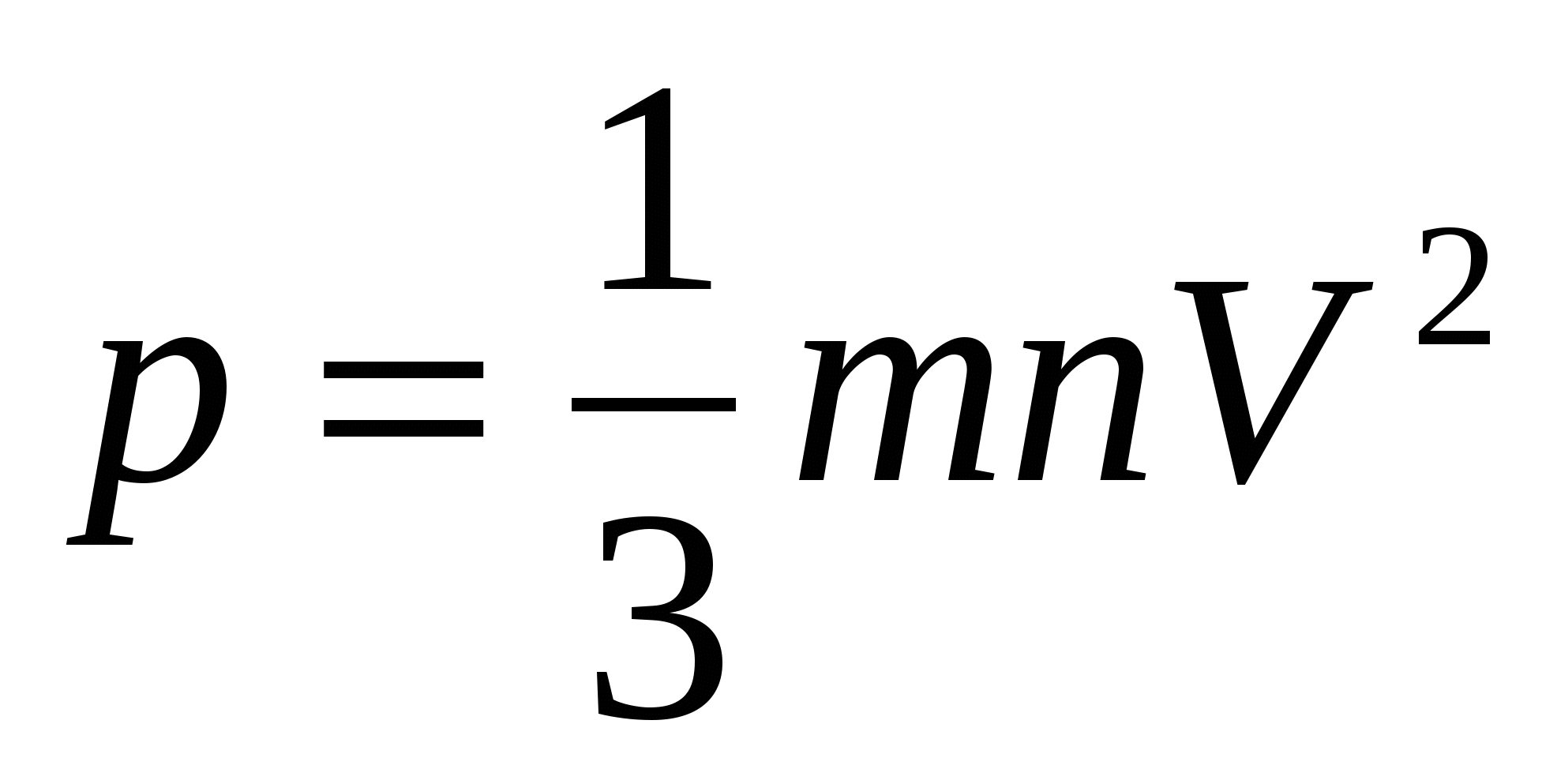 p - давление газа
p - давление газа
, где m - масса газа
n - концентрация
V2 - средняя квадратичная скорость молекул газа
2.Средняя кинетическая энергия газа
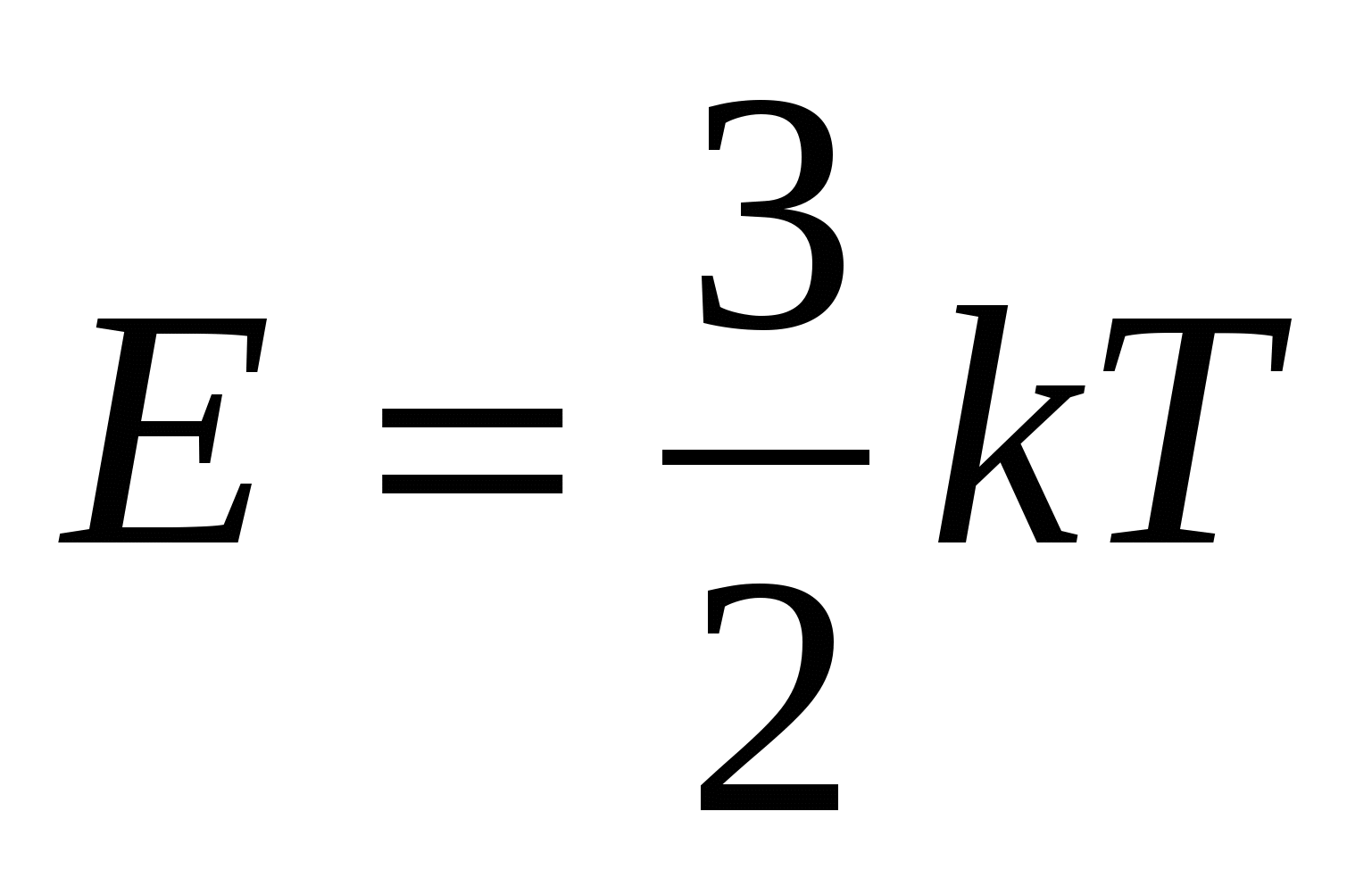 E - средняя кинетическая энергия движения молекул газа
E - средняя кинетическая энергия движения молекул газа
, где k - постоянная Больцмана
T - температура газа
-
Уравнение Менделеева - Клапейрона
,
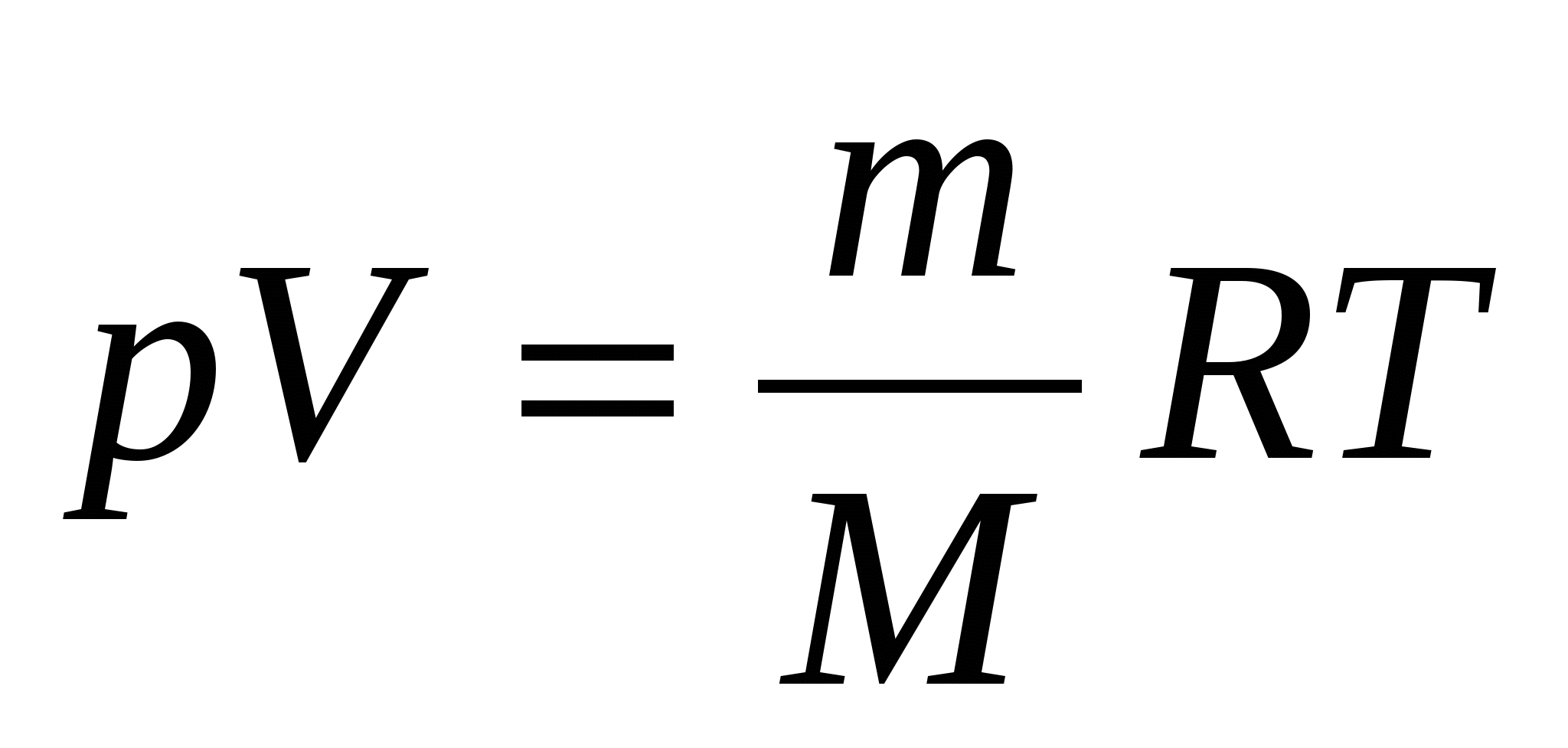 где p - давление газа
где p - давление газа
V - объём газа
m - масса газа в кг
М - молярная масса
R - универсальная газовая постоянная
T - температура газа
ТЕПЛОВЫЕ ПРОЦЕССЫ
Таблица 1
Процесс
Формула
Обозначения
Сгорания топлива
Q=qm
q- удельная теплота сгорания топлива
Нагревание или охлаждение
Q=cmΔТ
c-удельная теплоёмкость вещества
m - масса, ΔТ- изменение температуры
Кипение или конденсация
Q=±rm
r- удельная теплота парообразования
Плавление или кристаллизация
Q=±lm
l- удельная теплота плавления вещества
ОСНОВНЫЕ ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ
Таблица 2
Величина
Единица измерения
Формула
Название
Обозначение
Наименование
Обозначение
Связь с единицей СИ
масса
m
килограмм
кг
1 г=10-3кг
-
плотность
ρ
килограмм на кубический метр
кг/м3
1г/см3=103кг/м3
![]()
молярная масса
M
килограмм на моль
кг/моль
1г/моль=10-3кг/моль
![]()
Количество вещества
ν
моль
моль
1 кмоль=1000 моль
![]()
Объём
V
литр
л
1 л = 10-3м3
-
Давление
p
Паскаль
Па
1 Па = 1Н/м2
![]()
Температура
Т
Кельвин
К
0 К = -273˚С
-
Число молекул
N
-
-
-
![]()
Работа газа
А
Джоуль
Дж
-
A=pΔV
Внутренняя энергия
U
Джоуль
Дж
-
![]()
Количество теплоты
Q
Джоуль
Дж
1 кал =4,1868 Дж
Q=cmΔT
КПД теплового двигателя
η
процент
%
-
![]()
ФУНДАМАНТАЛЬНЫЕ ФИЗИЧЕСКИЕ КОНСТАНТЫ
R=8,31 Дж/моль·К - универсальная газовая постоянная
Na=6,02·1023 моль-1 - постоянная Авагадро
k=1,38·10-23 Дж/К - постоянная Больцмана
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача 1: В баллоне вместимостью 100 л при нормальных условиях содержится 8,9·10-3 кг газа. Определить молярную массу этого газа.
Д
 ано: СИ Решение:
ано: СИ Решение:
V=100 л 0, 1 м3 По уравнению Менделеева - Клапейрона
p=760 мм рт. ст. 1,01·105 Па 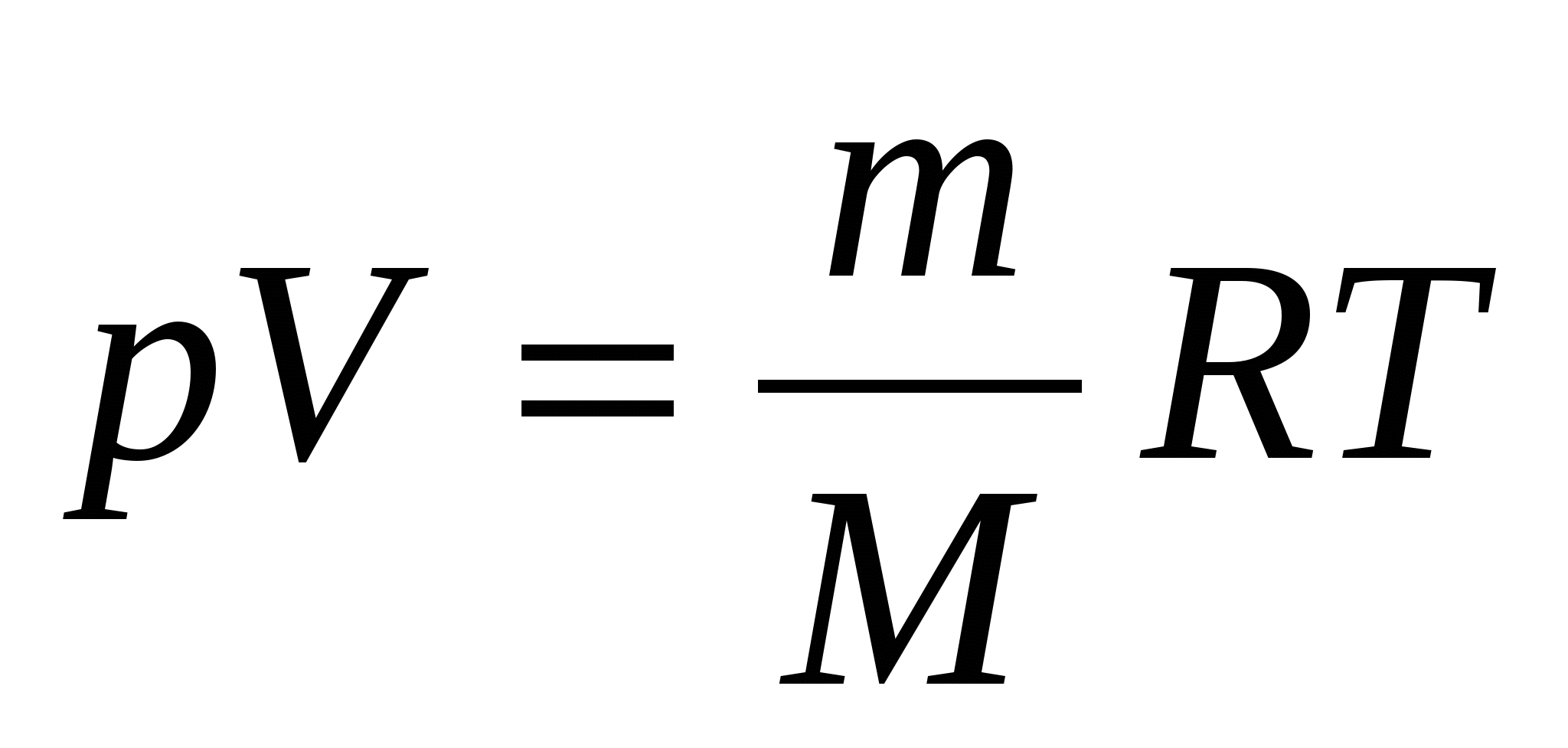
Т=273 К 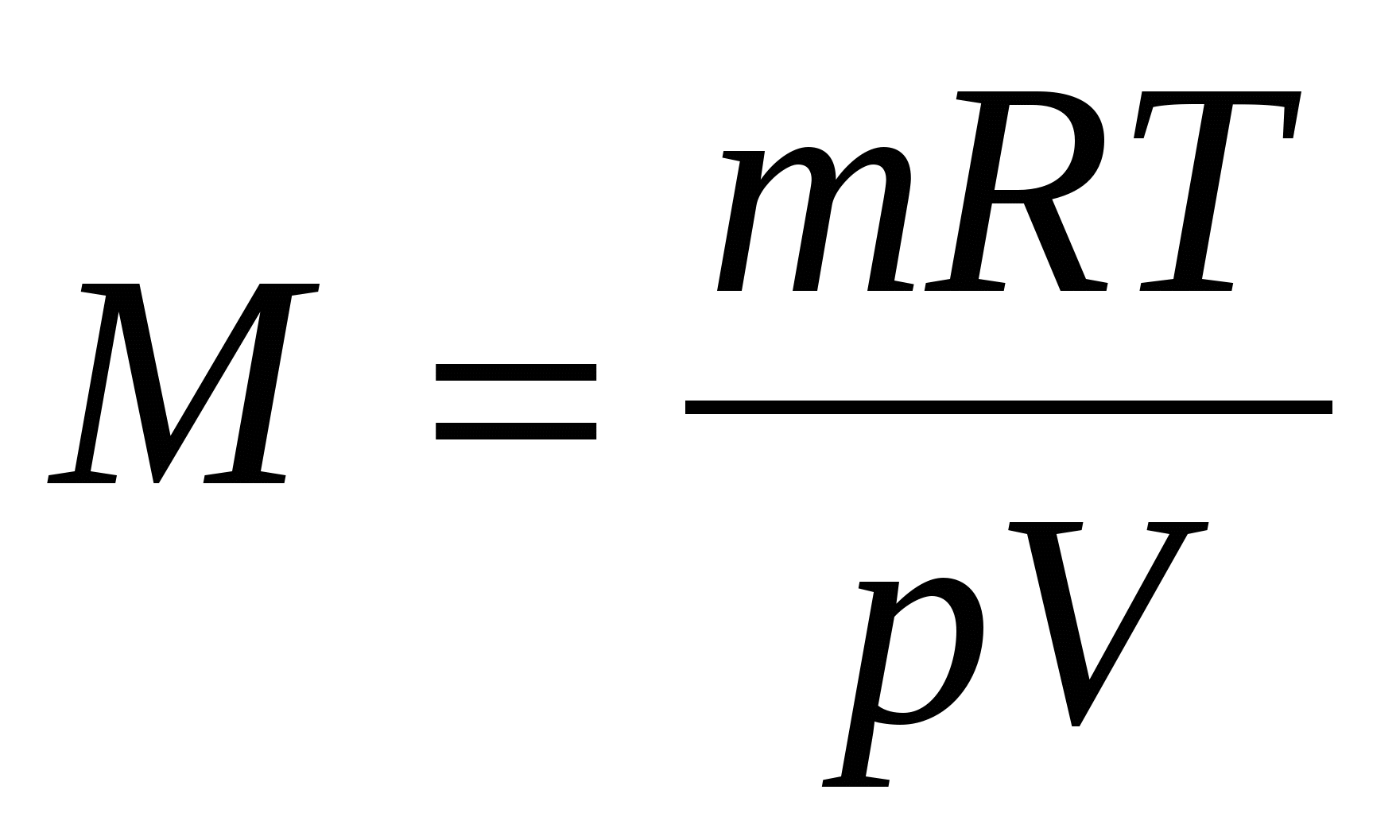
m=8,9·10-3 кг
Найти: М-?
Задача 2: Определить работу расширения 20 л газа при изобарном нагревании от 300 К до 393 К. Давление газа 80 кПа.
Д
 ано: СИ Решение:
ано: СИ Решение:
V1=20 л 20·10-3 м3 Работа расширения газа при изобарном нагревании
Т1= 300 К A=p(V2-V1)
Т2 = 393 К Так как при изобарном процессе  , то
, то
p=80 кПа 80·103 Па 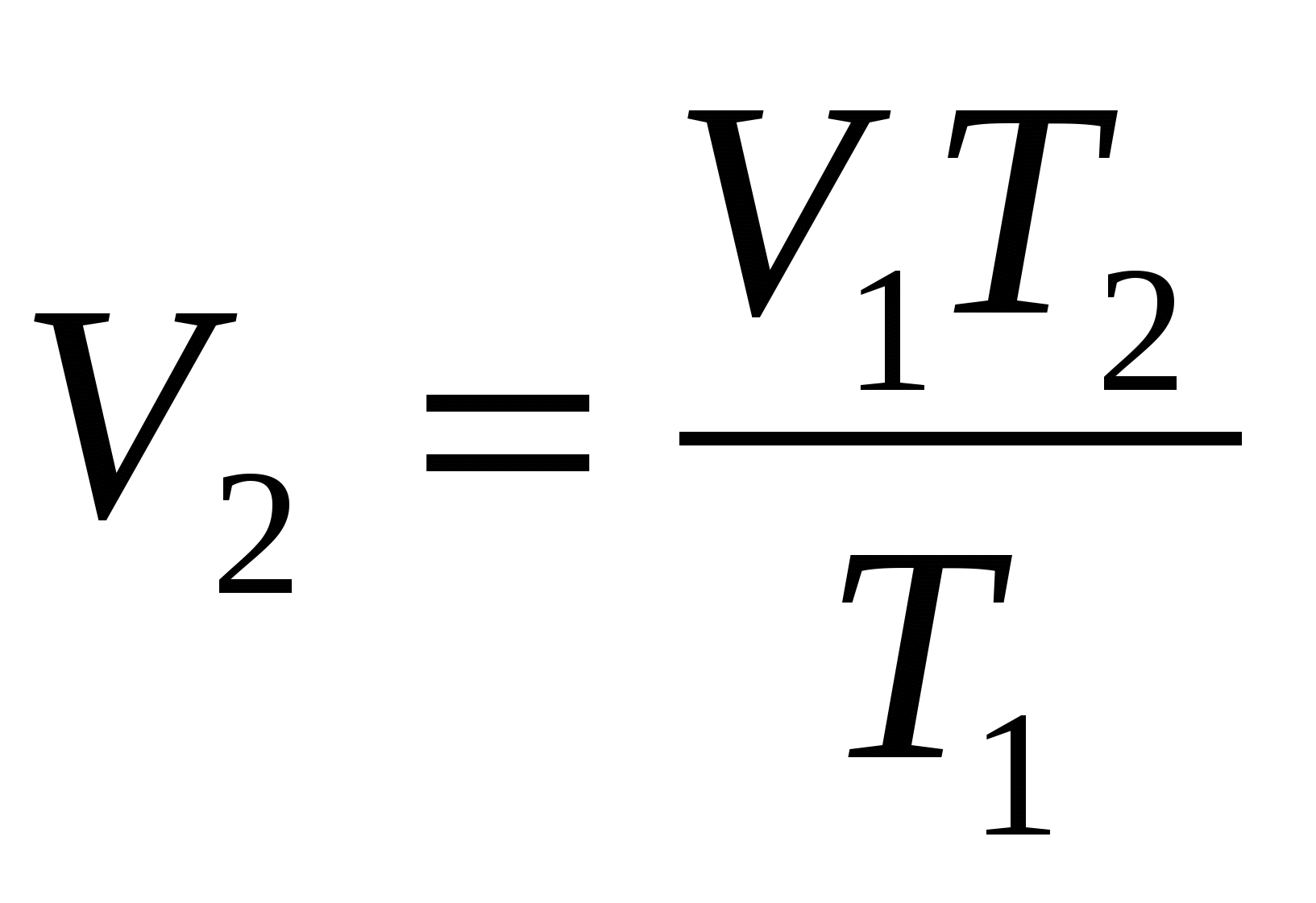 . Тогда
. Тогда
Найти А-? 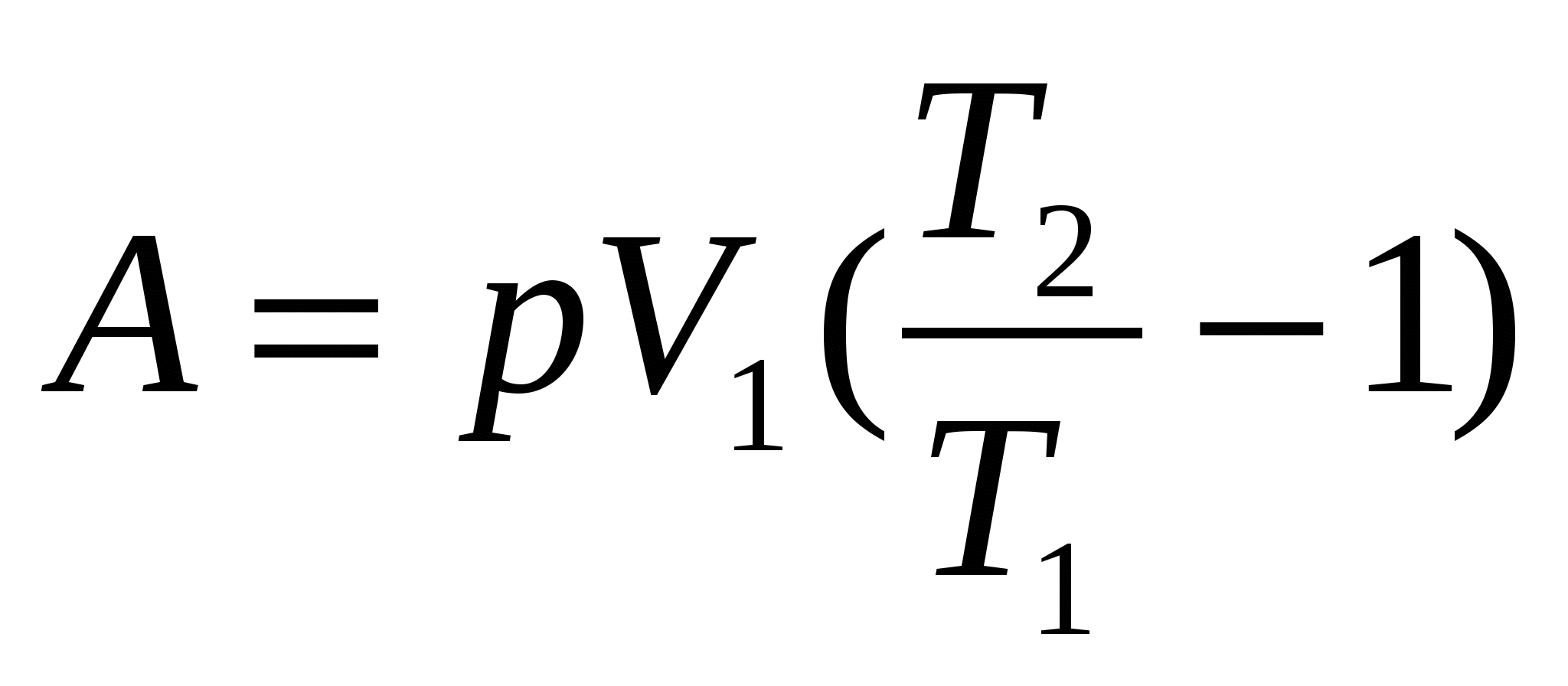
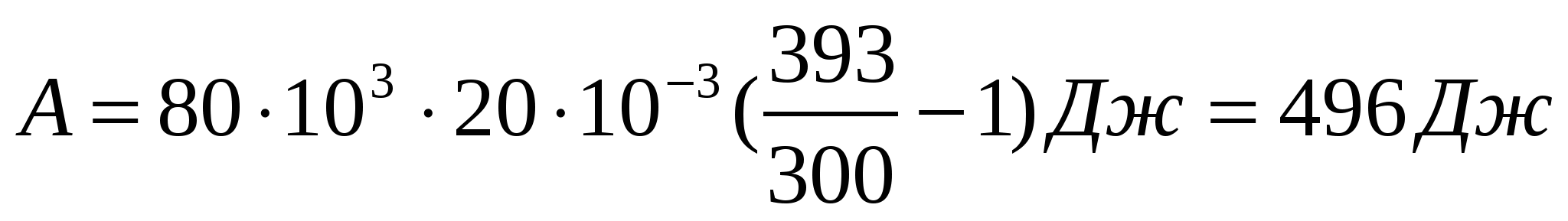
Задача 3: Определить коэффициент полезного действия плавильной печи, в которой для нагревания 0,5 т алюминия от 282 К до температуры плавления было израсходовано 70 кг каменного угля марки А-1.
Д
 ано: СИ Решение:
ано: СИ Решение:
mа=0,5 т 500 кг Из таблиц определим с=880 Дж/кг·К - удельная
Т1= 282 К теплоёмкость алюминия
mу=70 кг q=2,05·107 Дж/кг - удельная теплота сгорания
Тпл=932 К угля.
Найти η-? Для нагревания алюминия до температуры плавления
потребуется количество теплоты, вычисляемое по ф.
Qполезное=cma(Tпл-T1)
При сжигании угля выделяется количество теплоты, определяемое по формуле
Qзатраченное=qmу
КПД печи определяется соотношением 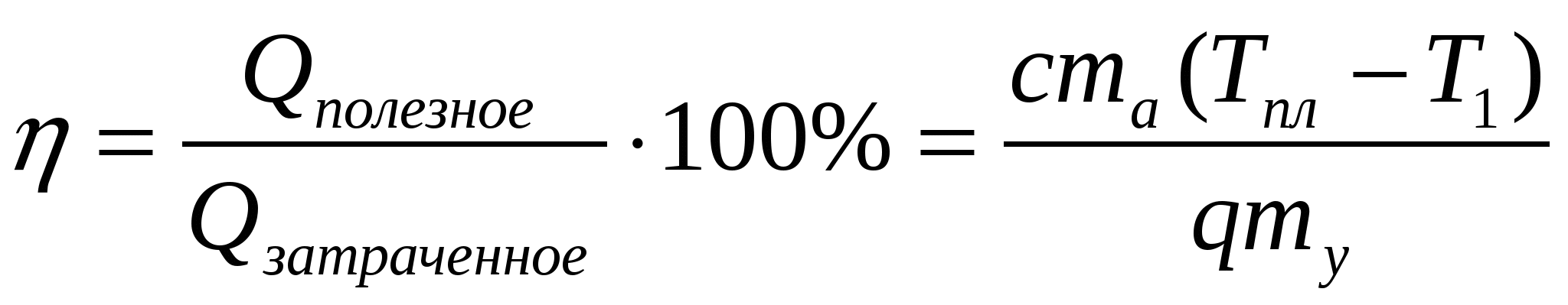
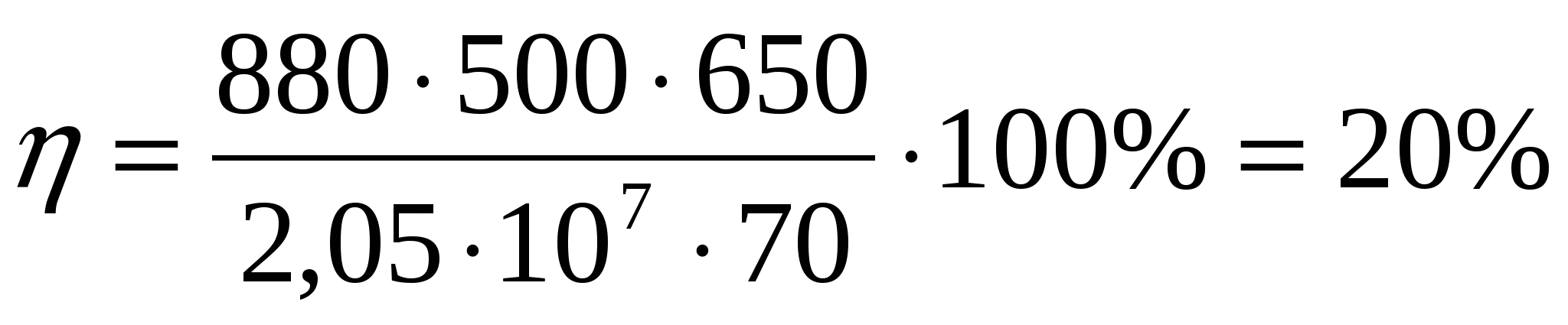
ИСПОЛЬЗУЕМАЯ ЛИТЕРАТУРА
-
Б. М. Яровский, Ю. А. Селезнев Справочное руководство по физике. - 4 - е изд., испр, - М.: Наука, 1999
-
Дмитриева В. Ф. Учеб. Пособие для техникумов. / Под ред. В. Л. Прокофьева. - 2-е изд. испр. и доп. - М.: Высш. шк., 1999
6


