- Преподавателю
- Физика
- Разработка урока к презентации Электрический ток в электролитах
Разработка урока к презентации Электрический ток в электролитах
| Раздел | Физика |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Шалимова Т.А. |
| Дата | 21.03.2015 |
| Формат | doc |
| Изображения | Есть |
Электрический ток в электролитах
Тема урока: «Электрический ток в электролитах»
Предмет: физика (11 класс).
Цель урока:
- сформировать у учащихся представление об электролизе и его практическом применении для развития учебно- познавательной компетентности
- организовать поле творческого общения и использования разных источников информации для развития информационно- коммуникативной компетентности
- создать условия для овладения навыками рефлексии, исследовательскими навыками
Средства обучения: аудитория, : ноутбук, проектор, экран, презентация на электронном носителе, дидактический материал - 6шт., листы (1\2 ватмана) - 6шт., фломастеры - 5 комплектов, литература [6 - 10], для эксперимента: 5 источников тока, 5 ламп , 18 соединительных проводов, 5 пар электродов, 5 электролитических ванн, порошки: СuSO4 ,NaCl, (или лимонная кислота, сахар-песок), дистиллированная вода, скотч.[L-микро лаборатория]
Тип урока : интегрированный урок получения новых знаний
Урок рассчитан на языковые классы финно - угорской школы
Методы: На уроке используется приемы метода развивающего обучения, в основе которого лежит принцип деятельностного подхода.
Форма обучения : групповая, парная
Д\з к этому уроку: каждая группа должна подготовить слайд- плакат по теме «Применение электролиза», «биография Фарадея» и подготовиться к защите плаката, на перемене группа договаривается о том, с каким плакатом они будут выступать и помещают свою заготовку на рабочий стол ноутбука.
Ход урока: 1. Актуализация знаний (слайд 1)
Наноматериалы, нанотехнологии, - эти слова мы слышим каждый день
Приставка нано означает 10 -9. Примером наноматериалов могут служить пористые оксидные пленки, размер пор которых имеет толщину порядка 10 -9м, поэтому поры можно увидеть только в электронный микроскоп. Это даже не поры, а длинные трубочки -фильтры. Посмотрите на экран, как они выглядят. Изучением свойств таких материалов занимается лаборатория, которая находится в Педагогической Академии на набережной напротив Мэрии у нас в Петрозаводске. Где могут применятся такие пленки?
.- Нанокомпозиционные серебросодержащие материалы могут использоваться в медицине как бактерецидные покрытия.
Их отличие от аналогов УФ излучателей, озонаторов:
-
не потребляют энергию
-
устойчивы к воздействию среды(t0,влажность)
-
работают в присутствии человека
-
экологически безопасны, нетоксичны
-
низкая стоимость
- Каталитическиактивные материалы ( оксидные пленки алюминия и титана) могут использоваться в автомобильной промышленности: наличие оксидной пленки на выхлопной трубе автомобиля уменьшает выбросы СО в атмосферу в 3раза .[10]
Технология получения пористых оксидных пленок называется анодированием.
Очень актуально, что сегодня на уроке мы знакомимся с явлением электролиза, лежащем в основе технологии получения таких пленок.
2. Приобретение исследовательских навыков - Групповой эксперимент(слайды 4- 6)
Проводим эксперимент по инструкции в дидактическом материале, афишируем результаты на доске, заполняем карту урока, даем определение электролитам.
Шалимова Т.А. 257-131-355
3. Получение новых знаний:
Электролитическая диссоциация (слайды 7 - 9)
Комментируем Слайд 7, слайд 8 ( Если слайды нажать друг за другом получается эффект разрыва связи между ионами): молекулы кристаллического Na Cl окружают полярные молекулы воды, отрицательным полюсом направленные к Na+, а положительным к Cl- и растягивают ионы в разные стороны, при этом молекулы Na Cl еще участвуют в тепловом движении. Это приводит к разрыву связи Na+ и Cl- и образованию двух ионов.
Записываем реакции диссоциации в дидактический материал, даем определение диссоциации: распад электролита на ионы называется электролитической диссоциацией.
Механизм проводимости (слайды 10 - 13)
Рассказываем, что ионы в отсутствии поля движутся беспорядочно - это тепловое движение Слайд 10 и показываем и х направленное движение; отрицательные от Катода к Аноду, положительные в противоположную сторону, используя анимацию Слайд 11.
х направленное движение; отрицательные от Катода к Аноду, положительные в противоположную сторону, используя анимацию Слайд 11.
Даем определение электрического тока в электролитах: Электрический ток в электролитах - это направленное движение ионов
Электролиз ( слайды 13 - 18)
Объясняем, что происходит на электродах: Катод - отрицательно заряжен, на нем избыток электронов и когда положительный ион подойдет к Катоду, Катод отдаст ему электрон - на Катоде произойдет восстановление металла. Анод - положительно заряжен, на нем недостаток электронов и когда отрицательный ион (с избытком электронов) подойдет к Аноду, он отдаст Аноду свой электрон и на Аноде произойдет процесс окисления, даем определение электролиза: Окислительно - восстановительные процессы под действием электрического тока называются электролизом. Показываем классу катод на котором выделилась тонкая полоска меди, взяв электрод у группы, которая работала с CuSO4, предлагаем записать схему электролиза сульфата меди, пользуясь правилами электролиза, пишем схему электролиза в дидактический материал. Это задание повышенной сложности и проводится с целью показать связь физики с химией.
Комментируем схему электролиза:
Р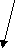
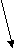 -р CuSO4Cu2+ + SO4 2-
-р CuSO4Cu2+ + SO4 2-
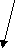
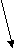 H2O H+ + OH-
H2O H+ + OH-
К(-) А(+)
 Сu 2+ +2e Cu 0 4OH - -- 4e O 2 0 + H 2 O
Сu 2+ +2e Cu 0 4OH - -- 4e O 2 0 + H 2 O
Итог: СuSO 4 +HOH эл.ток Сu0+O 2 0+ 2H 2 O +H 2 SO 4
 cерная кислота!
cерная кислота!
Обмениваемся работами, сверяем свои схемы с экраном и выставляем друг другу в\о.
Обобщенный закон электролиза ( слайды 19 - 20)
Слушаем выступление по своему слайду с сообщением «биография Фарадея», делая вывод о том, что стремление к знаниям - пример для подражания.
Знакомимся с законами электролиза (* без вывода формул):
Масса вещества, выделившегося на электроде, пропорциональна общему заряду, прошедшему через электролит
m= kQ 1закон Фарадея k =μ\Fn 2закон Фарадея *m=miN=miQ\qi k=mi\qi m=kQ k=mi\qi mi= μ\Na qi= en k= μ\Naen F=Nae k= μ\Fn
Q=It
m=μIt\Fn - обобщенный закон электролиза
и организуем работу Эхо (повторяем за учителем) на запоминание новых постоянных и физических величин Слайд 20
Шалимова Т.А. 257-131-355
4. Решение задач на закон электролиза (слайды 21 - 23)
Слайд 21Объясняем решение задачи № 895 из задачника Рымкевича, особое внимание уделяя алгоритму решения, решаем задачи на законы электролиза самостоятельно по вариантам и выставляем с\ о Слайд 22, слайд №23
5. Применение электролиза (защита плаката по своим слайдам)
Объявляем конкурс плакатов на применение электролиза. Конкурс плаката!
Выбираем хранителя времени, эксперта, голосуем за критерий оценки выступления
или вносим свои поправки, выступаем по своим творческим заготовкам, заполняем карту урока, присуждаем 1 место группе, выступавшей с плакатом «гальваностегия»
6. Итоги урока Слайд 26 Записываем д\з, сдаем дидактический материал, не забываем отметить трудные задания - Т, интересные задания -И и полностью заполнить карту урока. .
Рекомендации к использованию:
- План урока пишем на доске, т.к. в течение урока к нему постоянно возвращаемся.
- Слайды 5, 9, 17, 22, 23, 26 - проверь себя, используем для мгновенного контроля и самооценки
- Слайды 18, 25 (плакаты учеников прошлого года) - используем, если группа не сделала Д\з
- Слайд 20 - для проведения работы «Эхо».
- Дидактический материал содержит инструкцию для проведения эксперимента, правила электролиза, задания для учеников, карту урока для выставления самооценок, Д\з задачи по желанию (эти задачи учащиеся обычно фотографируют на телефон).
Дидактический материал предлагается для 5-6 групп, т.к. проводится 5-6 опытов, вторая страница дидактического материала - это обратная сторона каждого материала. Дидактический материал выдается каждому ученику группы.
- Если урок 2 часовой плакаты рисуем в классе, используя литературу [5-9] и отводим больше времени на итоговую рефлексию
- Проводим урок с учителем химии или я справляюсь сама т.к. это тема моего диплома на 5 курсе ПГУ
- Учителя химии просим повторить с учащимися тему «электролиз», т.к. они изучали эту тему в прошлом году.
- Для успешности эксперимента порошок медного купороса, поваренной соли, ( или лимонной кислоты, сахарного песка) подсушиваем на батареи перед уроком.
Использовались:
-
Капустин Н. П. Педагогические технологии адаптивной школы
издательский центр «Академия» 2002г
-
Акулова О.В. и др. Конструирование ситуационных задач
для оценки компетентности учащихся
-
журнал «химия в школе» № ? 199?г
-
youtube. com опыты по электролизу
-
Шахмаев Н.М.и др. Элементарный курс физики стр. 179
-
Алексеева М.Н. Физика юным стр.96
-
Ходаков Ю.В. и др. Неорганическая химия 9 стр.112
-
физика 10 под ред. Пинского А.А. стр.331
-
Шахмаев Н.М. физика 10 стр.221-223
-
Яковлева Н.М. выступление на конференции «Шаг в будущее» 2012г
Шалимова Т.А. 257-131-355



