- Преподавателю
- Другое
- Исследовательская работа Исследование физико-химического состава воды пруда «Северный»
Исследовательская работа Исследование физико-химического состава воды пруда «Северный»
| Раздел | Другое |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Исхакова Р.У. |
| Дата | 03.10.2014 |
| Формат | doc |
| Изображения | Есть |
Республиканская экологическая акция "Живая вода Башкортостана"
Проект
Исследование физико-химического состава воды пруда
«Северный».
Выполнили: Халиева Зарина, Смолева Индира, ученицы 11 -ого класса члены экологического кружка "Аметист" от СЮТ
МОУ СОШ с. Октябрьское, Стерлитамакского района РБ
Руководитель: учитель химии
Исхакова Р.У. МОУ СОШ с.Октябрьское
Стерлитамакский район.
2007
Оглавление.
Введение.______________________________________________________3 стр.
1 Глава. Изучение физико-химических показателей воды.
1.1.Обзор литературы._________________________________________4 стр.
1.2. Основные показатели качества воды.
2 Глава. Экспериментальная часть.
2.1.Определение органолептических свойств воды
(запах, цвет, вкус, прозрачность).________________________________6 стр.
2.2. Определение физико-химических свойств воды.
2.2.1. Определение реакции.________________________________6 стр.
2.2.2. Определение содержания аммиака._____________________7 стр.
2.2.3. Определение жесткости воды
комплексометрическим методом.__________________________7 стр.
2.2.4.Определение восстановителей, содержащихся в воде («окисляемость»), йодометрическим методом._______________8 стр.
2.2.5. Определение содержания сульфат-иона титрованием хлористым барием._______________________________________________10 стр.
2.2.6.Определение содержания хлорид-иона титрованием азотнокислым серебром._____________________________________________12 стр.
2.3. Обобщение и выводы. ____________________________________13 стр.
Заключение.
Список литературы.___________________________________________15 стр.
Приложение.__________________________________________________16 стр.
Введение.
Данная работа является одной из составных частей исследований, проводимых членами экологического кружка «Аметист» по изучению физико- химического состава водных источников села Октябрьское. Они были начаты в сентябре 2002 года. Одним из таких источников является пруд "Северный".(Приложение №)
Проблема качества воды затрагивает многие стороны жизни человеческого общества и поэтому тема нашей исследовательской работы выбрана не случайно. Мы настолько привыкли к воде, что стали забывать, что вода - это самое уникальное и необычное вещество в природе. Мы привыкли к ней, так как вода единственная жидкость, которую постоянно можно найти вокруг нас при обычных условиях. Она течет из-под крана на кухне и в ванне, она есть в колодцах, прудах, в озерах, морях. Мы пьём её, используем для плаванья, умывания, приготовления пищи. Но в последнее время происходит резкое ухудшение качества не только питьевой воды, потребление которой может привести к неприятным последствиям, но и других источников, что и наблюдается в нашей деревне - с нашим прудом «Северный».
Гипотезой исследования явилось предположение о том, что причиной изменения физико-химического воды зависит от практической деятельности людей.
Цель исследования: теоретически обосновать и экспериментально проверить, верна ли наша гипотеза.
Для достижения данной цели мы поставили перед собой следующие задачи:
-
продолжить изучение литературы;
-
продолжить изучение химических показателей воды, изучение методики выполнения измерения (МВИ) содержания сульфат-ионов титрованием хлористым барием и хлорид-ионов - азотнокислым серебром, МВИ определения жесткости воды комплексонометрическим методом, восстановителей, содержащихся в воде (окисляемость) йодометрическим способом, органолептических свойств воды, определение содержания аммиака (азота аммонийных солей) с реактивом Несслера;
-
проанализировать результаты исследования.
Объектом исследования явился пруд "Северный".
Предметом исследования стала вода (её физико-химический состав).
Методы исследования: наблюдение, анализ литературы, химический эксперимент.
Базой исследования стала школьная химическая лаборатория МОУ СОШ с.Октябрьское Стерлитамакского района Республики Башкортостан.
Практическое значение работы состоит в том, что мы узнаем, влияет ли практическая деятельность жителей деревни на физико-химический состав воды
Структура работы состоит из введения, двух глав, обобщений и выводов, списка литературы, приложения.
Глава I. Изучение физико-химических показателей воды.
1.1.Обзор литературы.
Вода - самое обыденное и в тоже время самое удивительное вещество на нашей планете - обладает рядом необычных, неожиданных свойств. Во-первых, она согревает нас. Вода поглощает солнечное тепло и, медленно остывая, отдает его понемногу атмосфере. Поэтому на Земле не бывает таких резких перепадов температур, как, скажем, на Марсе. Во-вторых, не только жидкая вода, но и пары - также наши спасители. Если бы атмосфера не содержала водяных паров, космический холод давным-давно добрался бы до нас и заморозил бы все на свете, а так, «шуба» - атмосфера с «подстежкой» из водяных паров не дает нам замерзнуть. Вода - это спасительница земли. И если бы только это! Сама наша жизнь зародилась в воде, из нее вышли на сушу наши пра-пра-предки, да и сейчас соленая морская вода все еще плещется в наших жилах - это наша соленая кровь, без которой жизнь невозможна. Словом, где нет воды, там нет и земной жизни. (4, стр.4).
Откуда столько воды? Да и так ли проста вода, как нам кажется? Известный ученый Лорен Эйсли писал: «Она есть повсюду; она соприкасается с прошлым и готовит будущее; она струится под полюсами и присутствует на больших высотах. Если и есть что-то загадочное на этой планете, так это вода». Трудно поверить, что обычная вода таит в себе какие-то тайны и загадки. Откуда берется вода? Подземные источники пронизывают почву планеты как кровеносная система. Но, если речь зашла о кровеносной системе, то получается, что подземная вода - это кровь Земли, огромного живого существа, хотя и непохожего на нас с вами. Тогда атмосфера, а также океаны и моря - это «кожа» Земли, которая защищает ее от губительного воздействия космоса. Защищает и дает возможность существовать на ней многочисленным живым существам - от большущих китов до маленьких императоров ангелов. Мы живем только благодаря ей и потому, что питаемся ее материнским молоком - чистейшей водой. Где вода - там и жизнь, а где ее нет…. Впрочем, она есть везде - даже под барханами самых засушливых пустынь. Воды в земле, действительно, очень много, и ею можно пользоваться сколько угодно. Важно лишь не забывать, что мы ходим по живой планете, а не по безжизненному грунту. (4, стр31)
В настоящее время серьезным опасением для человечества является недостаток питьевой воды и ее качественные изменения, несоответствие санитарно-гигиеническим требованиям. Техногенная деятельность человека привела всю пресную воду поверхностных и подземных источников к загрязнению чужеродными для организма человека веществами - ксенобиотиками (гербициды, пестициды, продукты переработки нефти и пр.), которые в свою очередь в дальнейшем нередко распадаются на более токсичные. (10)
Бытовые, производственные, сельскохозяйственные отходы, а также дождевые стоки часто вызывают эвтрофикацию - обогащение воды.
В результате избыточного поступления в водоемы минеральных фосфатов и азотных веществ появляется «цветение» воды, ухудшаются физико-химические свойства, вода делается мутной, зеленой с неприятным привкусом и запахом. Создаются условия для буйного роста водорослей. Такой же рост наблюдается и при тепловом загрязнении. Отмирающие части водорослей и органические соединения разлагаются до простейших соединений. Продукты распада поглощают кислород воды и некоторые из них токсичны. Токсичные вещества выделяются при жизнедеятельности некоторых водорослей. При разложении образуется метан, сероводород и другие, вредные для живых организмов, соединения. В результате эвтрофикации могут возникнуть заморы рыб и других обитателей водоемов.
При использовании некачественной воды, без предварительного ее кипячения населением возможны вспышки желудочно-кишечных заболеваний, отравление скота и птицы. В воде обнаруживаются несколько тысяч органических веществ разных химических классов и групп. Органические соединения природного происхождения - гуминовые вещества, различные амины и другие, которые способны изменять органолептические свойства воды.(2, 508). Кроме того, наши односельчане могут столкнуться с проблемой микробиологической безопасности воды, потому что даже вода из подземных источников может содержать единичные клетки патогенных микроорганизмов. Но основную угрозу представляет вода, вторично загрязняемая микробами при нарушении герметичности водопроводной сети.
Проблема качества питьевой воды - это проблема социальная, политическая, медицинская, географическая, а также инженерная и экономическая. Таких проблем много в любой местности. Есть они и в нашей деревне, которые вызывают тревогу - «самочувствие» пруда. В природе вода не встречается в химически чистом виде, она представляет собой растворы сложного состава, которые включают газы (O2, CO2,H2S, CH4 и др.), органические и минеральные вещества. В движущихся потоках воды присутствуют взвешенные частицы. В природных водах найдено подавляющее большинство химических элементов. Воды океанов содержат в среднем 35г/дм3 (34,6-35%о) солей. Их основную часть составляют хлориды (88,7%),сульфаты (10,8%) и карбонаты (0,3%). Наименее минерализированные воды атмосферных осадков, ультрапресные воды горных потоков и пресных озер.(3, 90). Чистая пресная вода - большая ценность, но, к сожалению, ее природные ресурсы исчерпаемы. Мы, люди, должны беречь и защищать её от загрязнений, помнить, что она - важная составная часть среды нашего обитания. С некоторого времени жителей нашей деревни, да и нас, и наших одноклассников стали интересовать такие вопросы:
-
почему вода в нашем пруду имеет неприятный вкус и запах?
-
почему вода мутная весной и желто-зеленого цвета летом и осенью?
-
почему водонагревательные приборы покрываются белым, а иногда и желтым налетом?
-
почему нельзя купаться в нашем пруду, хотя наши родители с упоением рассказывают нам о том, каких они ловили карасей, карпов и сколько радостей им приносило купание и, что когда-то пруд являлся гордостью и украшением нашей деревни.
Прочитав специальную литературу, мы поняли, что анализ проб по ряду химических и микробиологических показателей даст ответы на эти вопросы..
1.2. Основные показатели качества воды.
-
Органолептические показатели (запах, привкус, цветность, мутность).
-
Токсикологические показатели (алюминий, свинец, мышьяк, фенолы, пестициды).
-
Показатели, влияющие на органонолептические свойства воды (pH, жесткость общая, нефтепродукты, железо, марганец, нитраты, кальций, магний, окисляемость перманганатная, сульфиды).
-
Химические вещества, образующиеся при обработке воды (хлор остаточный свободный, хлороформ, серебро).
-
Микробиологические показатели (термотолерантные колиформы или Е.coli, ОМЧ).
Требования к качеству воды устанавливаются в каждом конкретном случае в зависимости от назначения. При оценке качества воды, предназначенных для питьевых целей, согласно СанПин 2.1.4.1074-01, проводят химический анализ по очень большой номенклатуре показателей. Это - цветность, мутность, содержание железа, марганца, меди, общая жесткость, щелочность, кислотность, солесодержание, окисляемость, нефтепродукты, содержание нитратов, хлоридов, сульфатов, фторидов, гидрокарбонатов и др.(9)
2 Глава. Экспериментальная часть.
2.1.Определение органолептических свойств воды
(запах, цвет, вкус, прозрачность).
Запах воды определяется при обычной температуре и при нагревании до 60 С.
Качественно запах характеризуют как «хлорный», «землистый», «болотный», «нефтяной», «ароматический», «неопределенный» и т.д.. Количественно запах оценивают по пятибалльной системе (см табл. № 1). При определении запаха воды руки и платье не должны иметь посторонних запахов (духов и прочее), воздух помещения должен быть чистым.
Колбу емкостью 150-200 мл наполнили на 2/3 исследуемой водой. Закрыли часовым стеклом, ее интенсивно встряхнули и затем, быстро открыв, определили запах. Запах воды болотный. Запах отчетливый, обращающий внимание и делающий воду неприятной для питья. Мы оценили запах воды в 4 балла.
Вкус воды определяется только при уверенности, что она безопасна (отсутствуют ядовитые вещества и бактериальное загрязнение). Полость рта
ополаскивают 10 мл исследуемой воды, не проглатывая ее, и определяют вкус, который характеризуют как «солоноватый», «горький», «кислый», «сладкий». Привкус может быть «рыбный», «металлический», «неопределенный» и т. д. Интенсивность привкуса также оценивается в баллах.
Несмотря на болотный запах и очень неприятный внешний вид, мы все-таки рискнули попробовать на вкус воду, предварительно отстояв ее. Затем профильтровали и, наконец, попробовав на вкус, выяснили, что он «солоноватый», привкус «неопределенный». Мы оценили привкус воды в 5 баллов.
Прозрачность воды определяют обычно по печатному шрифту Снеллена. Исследуемую воду взболтали и доверху налили в бесцветный цилиндр, разделенный по высоте на сантиметры и снабженный внизу тубусом с зажимом. Дно цилиндра должно быть гладким. Под цилиндр на расстоянии 4 сантиметра от его дна помещают шрифт Снеллена и пытаются различить буквы через столб воды. Сначала шрифт прочесть не удалось, поэтому воду медленно выпустили через тубус в чашку Петри до тех пор, пока буквы не стали ясно видны. Высота столба воды в сантиметрах указывает на степень её прозрачности. У нашей воды прозрачность составила около 5 см.
Степень прозрачности можно характеризовать также её обратной величиной - мутностью. Количественно мутность определяется с помощью специального прибора - мутномера, в котором исследуемую воду сравнивают с эталонным раствором, приготовленным из инфузорной земли или каолина на дистиллированной воде. Мутность воды выражают в миллиграммах взвешенного вещества на 1 литр воды. Поскольку такого прибора у нас нет, мы просто определили, что вода очень мутная.
Цветность воды определяют качественно путём сравнения окраски профильтрованной воды (в количестве не менее 40мл) с окраской равного объёма дистиллированной воды. Цилиндры с пробою рассматривают над белым листом бумаги, характеризуя исследуемую воду как «бесцветная», «слабо - жёлтая», «буроватая» и т.д.(3, 40 ). Вода из пруда была слабо-желтая.
2.2. Определение физико-химических свойств воды
2.2.1. Определение реакции.
Природная вода обычно имеет слабощелочную реакцию. Кислую реакцию вода приобретает при наличии гуминовых веществ или при спуске в водоем промышленных сточных вод, содержащих кислоты.
Качественно реакцию (pH) определили по универсальной индикаторной бумаге. Для этого в пробирку налили исследуемую воду и погрузили в нее полоску бумаги. По извлечении бумаги сравнили ее окраску с эталонами шкалы универсального индикатора, соответствующими величинам pH от 1,0 до 10,0. В результате рН была равна 8,5, то есть среда слабощелочная.
2.2.2.Определение содержания аммиака (азота аммонийных солей).
Средства измерений, вспомогательные устройства, реактивы, материалы и растворы.
Реактив Несслера,
сегнетова соль(KNaC4H4O6 4H2O);
пробирки.
Методика проведения анализа.
Принцип определения аммиака основан на способности его соединений образовывать с реактивом Несслера йодистый меркураммоний (NH2Hg2OI), который имеет красно-бурую окраску. О наличии и количестве аммиака судят по интенсивности этой окраски. Реакция идет по уравнению
NH3+2K2(HgI4)+3KOH=NH2Hg2OI+7KI+2H2O
Соли кальция, магния, алюминия, железа также соединяются с реактивом Несслера, образуя окрашенный осадок, поэтому их необходимо предварительно связать раствором сегнетовой соли (KNaC4H4O6 4H2O).
Для выявления присутствия солей аммония в воде в пробирку налили 10 мл исследуемой воды, 0,2 мл сегнетовой соли и после перемешивания - 0,2 мл реактива Несслера. Появление желтой окраски указало на присутствие аммиака, количество которого можно приблизительно определить по таблице № 3.
В результате проведения 5 опытов определили, что аммиака содержалось около 9 мг/л. Повышенное количество аммиака говорит о том, что вода загрязнена веществами животного происхождения (рядом с прудом находится свинокомплекс, отходы которого стекают в воду).
2.2.3. Определение жесткости воды комплексонометрическим методом.
Определения проводились титриметрическим методом: Титриметрический анализ (объемный анализ) - это метод количественного анализа, основанный на том, что к раствору определяемого вещества постепенно прибавляют титрованный раствор реактива с известной концентрацией (титрант), пока его количество не станет эквивалентным количеству реагирующего с ним определяемого вещества. Определение веществ таким методом называется титрованием.
Проведение титрования. Определенный объем (примерно 10 мл) анализируемого раствора смешивается в колбе Эрленмейера с несколькими каплями раствора-индикатора. Титрованный раствор медленно (по каплям) добавляется из бюретки в колбу, до тех пор, пока изменение цвета индикатора не покажет точку эквивалентности. По шкале бюретки находится расход титрованного раствора.(6, 315)
Средства измерений, вспомогательные устройства, реактивы, материалы и растворы.
Для определения жесткости воды использовали комплексонометрический метод. Для работы нужны были следующие реактивы:
1.дистиллированная вода.
2.Раствор трилона Б; 0,1н
3.Индикаторы - эриохром черный, хромоген.
4.Гидроксид натрия 5 %,
5.Аммиачный буферный раствор.
Оборудование: колбы плоскодонные на 250 мл, бюретка, воронка, фильтры, химические стаканы, пипетки (50 мл, 100 мл).
Методика проведения анализа.
Метод основан на способности трилона Б (двунатриевой соли этилендиаминотетрауксусной кислоты) связывать ионы Ca и Mg в прочные комплексы. В тот же момент, когда ионы находящиеся в воде, связаны в комплекс, добавленный заранее индикатор эрихром черной изменит свою первоначальную окраску с красной на синюю с зеленоватым оттенком.
В коническую колбу емкостью 250 отобрали 100мл анализируемой воды, добавили 5мл аммиачно-буферного раствора (NH3 NH4) и 3-5 капель индикатора (эрихрома черного); раствор окрасился в красный цвет, после чего титровали 0,05н. раствором трилона Б, интенсивно перемешивая до изменения окраски воды в голубовато-зеленый. Каждый миллиметр 0,05н. раствора трилона Б соответствует 0,05мг экв. жесткости.
Обработка результатов и измерений.
Жесткость анализируемой воды вычисляли по формуле:
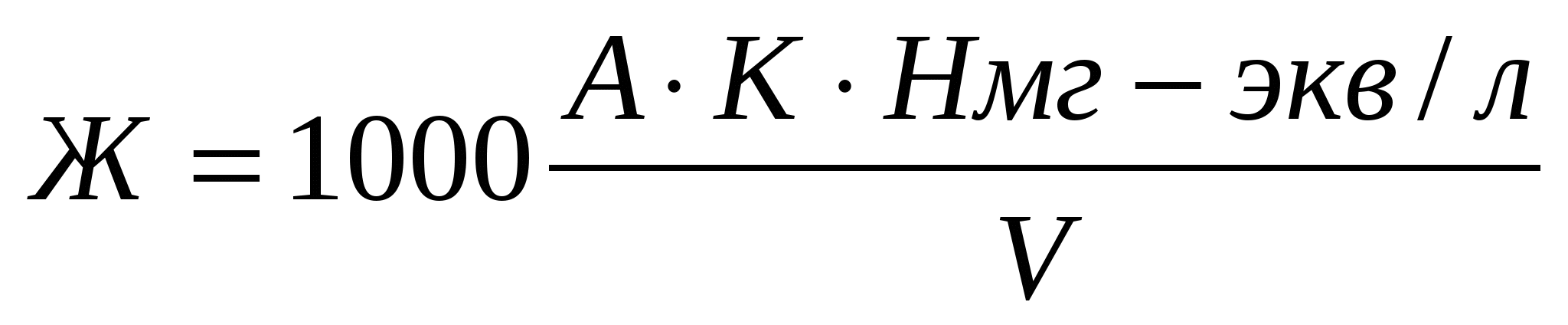
где V-объем пробы воды;
H-нормальность трилона Б
А-расход на титрование 0,05 н. раствора трилона Б, мл;
K-коэффициент поправки 0,05 н. раствора трилона Б;
1000-коэффициент для перерасчета на 1 л воды;
Например, на титрование затратилось трилона Б 4,3, тогда жесткость будет равна:
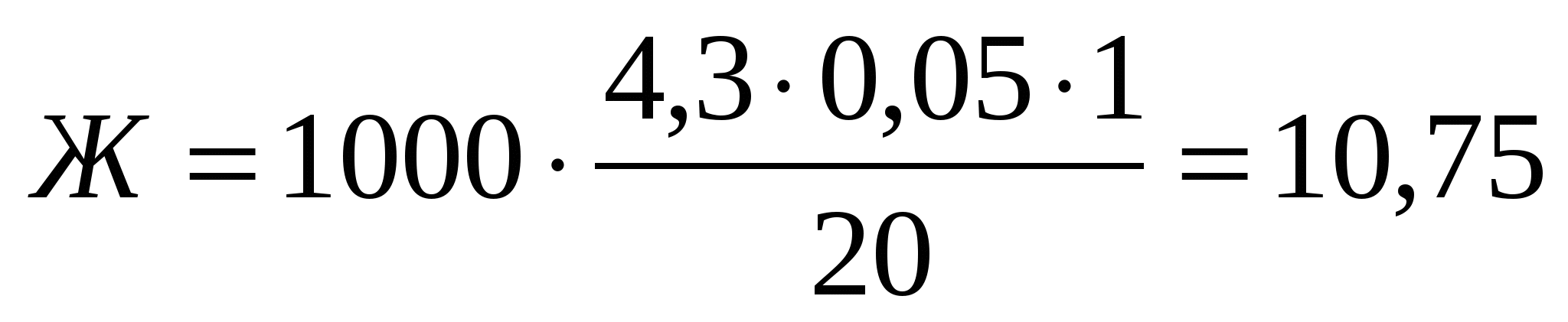 мг-экв/л
мг-экв/л
Для определения ионов кальция использовали те же реактивы кроме аммиачного буферного раствора и эриохрома, вместо них использовали 5% раствор гидроксида натрия и индикатор мурексид:
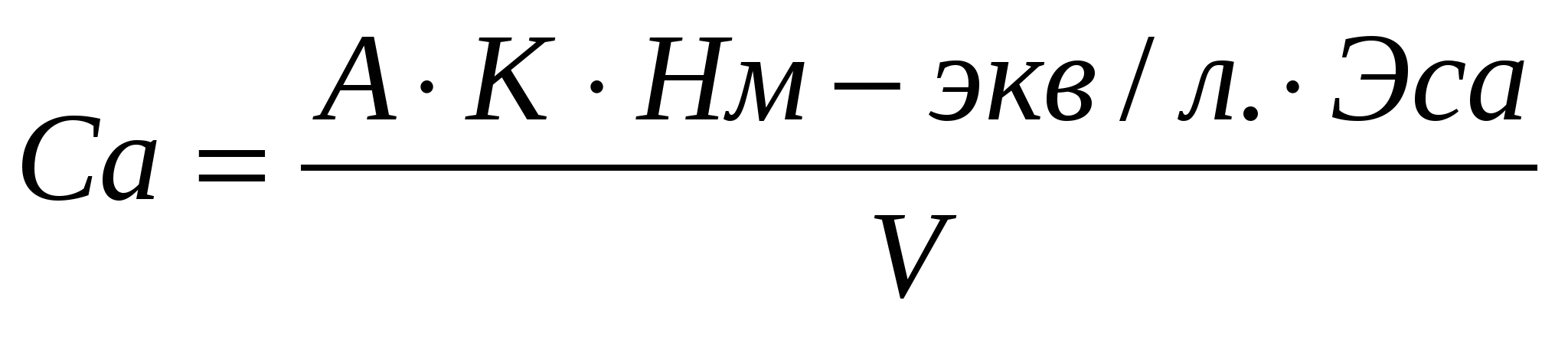 , или
, или
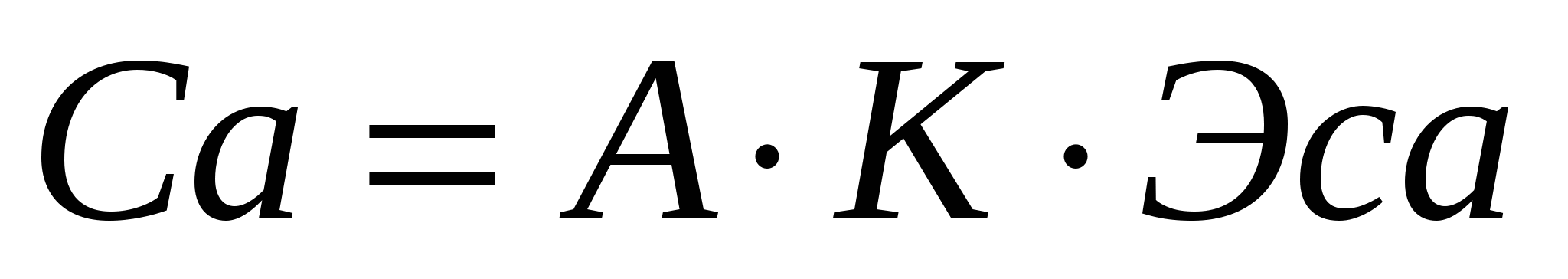
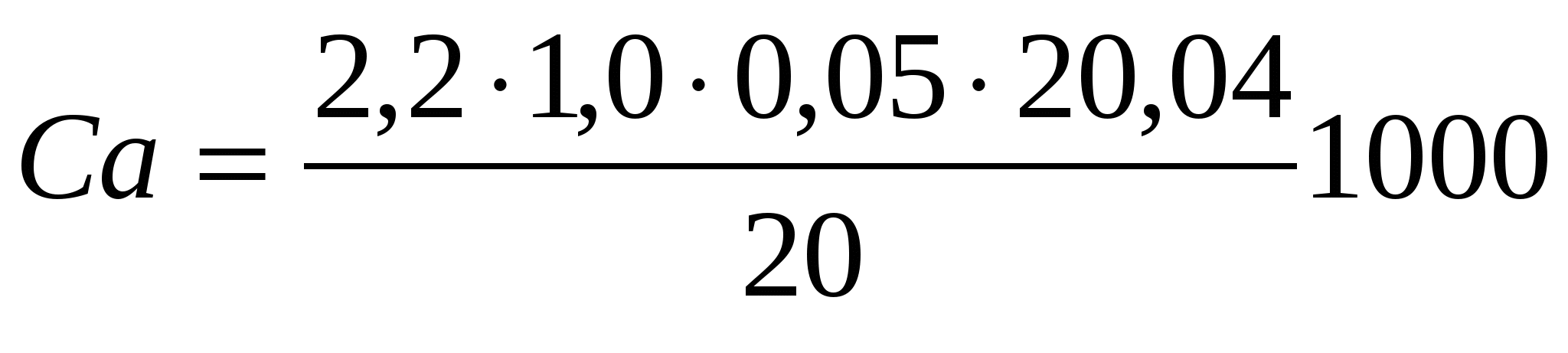
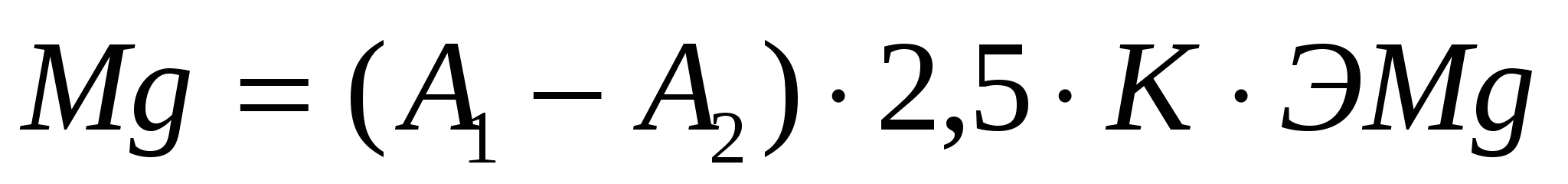
где А1-число миллилитров раствора трилона Б, израсходованное на титрование данного объма пробы для определения жесткости.
А2-число миллилитров раствора трилона Б, израсходованное на титрование данного объема пробы для определения кальция.
ЭMg и ЭCa -эквиваленты магния и кальция.
2,5-т.к на титрование взяли 20 мл. воды.
Mg = (4,3-2,2)∙2,5∙12,15 = 63,78
В результате проведенных 5 опытов выяснилось, что среднее количество ионов-магния-157,6, ионов кальция - 209,6. Такие результаты подтверждают, что действительно вода в пруду является жесткой. Пруд постепенно засыхает и концентрация ионов кальция и магния увеличивается, поэтому и увеличивается жесткость воды.
2.2.4. Определение восстановителей, содержащихся в воде («окисляемость»), йодометрическим методом.
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называется окисляемостью. Существуют несколько видов окисляемости воды; перманганатная, бихроматная, иодатная, цериевая.
Окисляемость выражается в миллиграммах кислорода, пошедшего на окисление органических веществ, содержащихся в 1 дм3 воды.
Состав органических веществ в природных водах формируются под влиянием многих факторов. К числу важнейших относятся внутриводоемные биохимические процессы продуцирования и трансформации, поступления из других водных объектов, с промышлеными и хозяйственно-бытовыми сточными водами. Образующие в водоеме и поступающие в него извне органические вещества, разнообразны по своей природе и химическим свойствам, в том числе по устойчивости к действию разных окислителей. Соотношение содержащихся в воде легко-и трудноокисляемых веществ в значительной мере влияет на окисляемость воды в условиях того или иного метода ее определения.
В поверхностных водах органические вещества находятся в растворенном, взвешенном и коллоидном состояниях. Последние в рутинном анализе не учитываются, поэтому различают окисляемость фильтрованных (растворенное органическое вещество) и нефильтрованных (общее содержание органических веществ) проб.
Величины окисляемости природных вод изменяются в пределах от долей миллиграммов до десятков миллиграммов в литре в зависимости общебиологической продуктивности водоемов, степени загрязненности органическими веществами и соединениями биогенных элементов, а также влияния органических веществ естественного происхождения, поступающих из болот, торфянников и тд. Поверхностные воды имеют более высокую окисляемость по сравнению с подземными (десятые и сотые доли мг/дм3 исключение составляют воды нефтяных месторождений и грунтовые воды, питающиеся за счет болот. Горные реки и озера характеризуются окисляемостью 2-3 мг О/дм3 , равнинные - 5-12 мг О/дм3, реки с болотным питанием- десятки миллиграммов на 1 дм3 .
Окисляемость является одним из тех показателей, которые влияют на органолептические свойства воды - запах, привкус, цветность, мутность.
Органические вещества, обусловливающие повышение значение перманганатной окисляемости, отрицательно влияют на печень, почки, репродуктивную функцию, а также на центральную нервную и иммунную систему человека. Вода, имеющая перманганатную окисляемость выше 2 мг О/дм3, не рекомендуется к употреблению. ПДК окисляемости-5мг О/дм3
Методика проведения анализа.
Метод основан на окислении присутствующих в воде веществ перманганатом калия в кислой среде, с последующим добавлением иодида калия, выделившийся йод (его количество эквивалентно непрореагировавшему перманганату калия (KMnO4) оттитровывают с тиосульфатом натрия (Na2S2O3)).
После титрования должно остаться около 40% введенного KMnO4 (на титрование должно пойти не более 6 мл 0,01 н Na2S2O3) Поскольку степень окисления зависит от концентрации. Если на титрование пошло более 6 мл, то пробу разбавляют. Проведению анализа мешают хлориды (более 300 мг/л), железо, нитриты, сульфиды. При содержании этих веществ менее 0,1 мг/л ими можно пренебречь. В противном случае их предварительно окисляют при комнатной температуре. К 100 мл исследуемой пробы прибавляют 10 мл 0,01 Н KMnO4, 5 мл Н2SO4 (1:3), 0,5г. KI и сразу после растворения KI титруют выделившийся йод 0,01 Н Na2S2O3. Объем тиосульфата учитывают при расчете окисляемости.
Средства измерений, вспомогательные устройства, реактивы, материалы и растворы.
Для того, чтобы более точно определять окисляемость, мы мысленно поделили пруд на четыре участка и с каждого делали забор воды по 100 мл. Затем воду перемешали и для анализа взяли 100 мл воды. Анализ повели в течении часа после забора воды. Использовали следующее оборудование: плоскодонная колба на 250 мл, бюретка, пипетки (10 мл, 5 мл) , воронка, мерные цилиндры. Реактивы: растворы перманганата калия, серной кислоты, тиосульфата натрия, иодида калия (кристаллический), крахмал 0,5% раствор.
Методика проведения анализа.
Перед началом анализа предварительно обработали колбу концентрированным раствором перманганата калия, подкисленного серной кислотой и прокипятили 5 минут. Образовавшийся на стенках колбы осадок растворили концентрированным соляной кислоты. Колбу ополоснули дистиллированной водой. Операцию повторили 2 раза. Затем в эту колбу отмерили мерным цилиндром 100 мл исследуемой воды (если вода сильно загрязнена, тогда брали 10 мл данной воды и разбавляем до 100 мл дистиллированной водой), добавили 5 мл серной кислоты (1:3), и начали нагревать. В самом начале кипения добавили 10 мл раствора перманганата калия 0,01 Н, цвет раствора стал темно-малиновым, кипятили 10 минут, закрыв колбу маленькой конической воронкой для уменьшения испарения. Затем смесь охладили и добавили 0,5 г иодида калия, цвет раствора стал ярко-желтым. Выделившийся йод оттитровали 0,01Н раствором тиосульфата натрия до слабо желтого цвета. Добавили 1 мл 0,5% раствора крахмала, цвет изменился до темно-синего и продолжили титровать по каплям до обесцвечивания раствора.
Параллельно проводили определение окисляемости холостой пробы (дистиллированная вода)
Обработка результатов и измерений. Величину перманганатной окисляемости (мгО/л) вычислили по формуле;
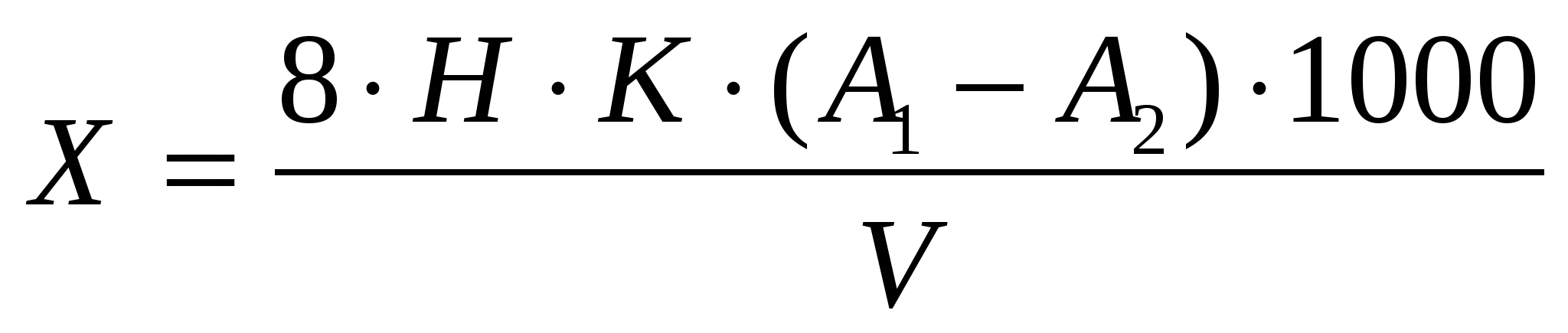
А! и А2-объем 0,01Н тиосульфата натрия, израсходованного на титрование холостой и исследуемой пробы, мл;
Н-нормальность раствора тиосульфата натрия;
8-эквивалент кислорода;
V-объем пробы, взятой для анализа, мл;
К- поправочный коэффициент к раствору Na2S2O3.
Например, на титрование воды из пруда пошло 3,5 мл тиосульфата натрия, а не дистиллированную воду - 8,1 мл. Рассчитываем по формуле:
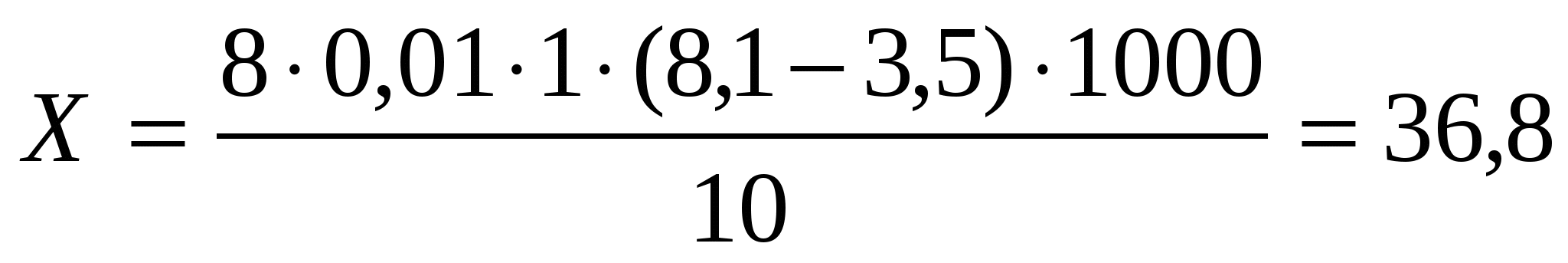 ,
,
В результате проведения 5 опытов, выяснилось, что окисляемость превышает норму в 7,5 раз. Это лишний раз подтверждает, что вода пруда не годиться для употребления. (Таблица № 4)
2.2.5.Определение содержания сульфат-иона титрованием хлористым барием.
Определения проводились титриметрическим методом: содержание сульфат-иона титрованием хлористым барием и содержание хлорид-иона титрованием азотнокислым серебром.
Проведение титрования. Определенный объем (примерно 10 мл) анализируемого раствора смешивается в колбе Эрленмейера с несколькими каплями раствора-индикатора. Титрованный раствор медленно (по каплям) добавляется из бюретки в колбу, до тех пор, пока изменение цвета индикатора не покажет точку эквивалентности. По шкале бюретки находится расход титрованного раствора.(6, 315)
Определение содержания сульфат-иона титрованием хлористым барием.
Для определения хлорид- и сульфат-ионов отбиралась отдельная проба с глубины 0,5 метров в полиэтиленовые бутылки. Затем вода доставлялась в школьную лабораторию и анализировалась примерно через 30 минут после отбора. Всего было проведено 5 анализов воды (Таблица№4)
Средства измерений, вспомогательные устройства, реактивы, материалы и растворы.
Вода из различных источников, хлорид бария, катионнообменная смола КУ-2, этиловый спирт (или ацетон), индикатор нитхромазо (2,7-бис(4-нитро-2-сульфофенол)-азо-1,8-диоксинафталин 3,6-дисульфокислота).
Колбы плоскодонные (250мл), колбы мерные, мерный цилиндр, бюретка, фильтр, пипетки градуированные.
Подготовка катионита к работе.
Смолу заливают на ночь дистиллированной водой. На следующий день воду сливают и на сутки заливают раствором соляной кислоты с концентрацией 1 моль/дм3. Окрасившийся раствор кислоты сливают, промывают смолу 2-3 раза дистиллированной водой декантацией и снова заливают раствором соляной кислоты. Такую процедуру повторяют до тех пор, пока раствор над смолой перестанет окрашиваться в желтый цвет. Затем катионит отмывают дистиллированной водой до рН= 6 (по индикаторной бумаге).
Регенерация катионита.
Отработанный катионит собирают в одну колбу и обрабатывают раствором соляной кислоты с концентрацией 1 моль/дм3, встряхивая 8-10 раз в
течение 8-10 минут. Раствор кислоты сливают, и катионит отмывают декантацией дистиллированной водой до рН=6.
Методика проведения анализа.
Измерение массовой концентрации сульфат-ионов выполняли титриметрическим методом с солью бария. Метод основан на способности
сульфат-ионов образовывать слаборастворимый осадок сернокислого бария
Избыток ионов бария определяли по изменению окраски (из фиолетовой до ярко-голубой) индикатором нитхромазо C22H14N6O18S4, который в эквивалентной точке титрования образует комплексное соединение с ионами
бария.
Для уменьшения растворимости осадка сульфата бария титрование проводили в водноспиртовой (водно-ацетоновой) среде. Мешающее влияние мутности устраняли фильтрованием. Для устранения влияния катионов пробу воды встряхивали с катионнообменной смолой КУ-2 в Н+ форме. Определению не мешают фториды, хлориды, нитриты и перхлораты
Подготовка воды к исследованию.
Пробу воды объёмом 50-100 мл поместили в коническую колбу 250мл, добавили 5-10 грамм подготовленного катионита КУ-2. Смесь в колбе встряхивали 8-10 раз в течение 10 минут, затем дали смоле осесть и отобрали 10-50 мл воды. Данную воду поместили в коническую плоскодонную колбу,
прилили равное количество спирта и 2 капли 0,2% раствора нитхромазо. Затем титровали 0,01 моль/л раствором хлорида бария до изменения цвета раствора из фиолетового в голубой.
В начальной стадии титрования, особенно в пробах с невысоким
содержанием сульфат-ионов, уже после добавления первых капель хлористого бария происходит изменение окраски из фиолетового в голубую. Титрование продолжали до тех пор, пока голубая окраска будет сохраняться в течение 2-3 минут.
Обработка результатов и измерений.
Массовую концентрацию сульфат-ионов (Х) мг/л вычисляется по формуле
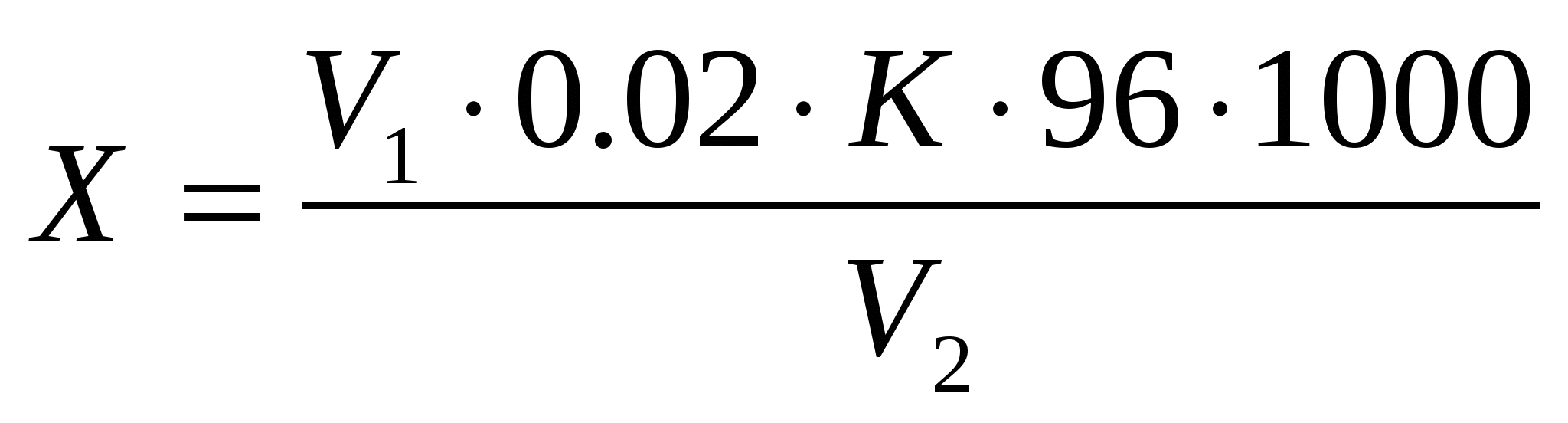
где:
V1 - объём раствора хлорида бария, израсходованного на титрование, см3
0.02 - концентрация раствора хлорида бария, моль/ дм3
K - поправочный коэффициент для приведения концентрации раствора хлорида бария точно к 0,01 моль/ дм3
96 - молекулярная масса сульфат-ионов мг;
V2- объём пробы воды, взятой для титрования, см3
Например, на титрование пошло хлорида бария 1,3 см3 мл, тогда
X=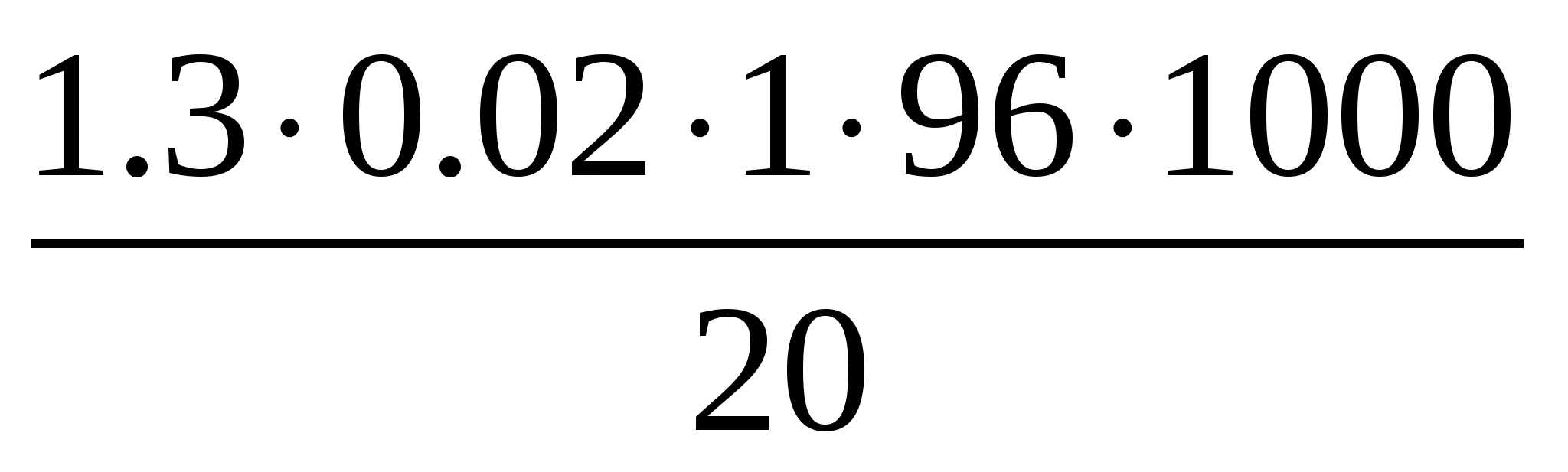 =124,8 мг/см3
=124,8 мг/см3
Среднее значение сульфат-ионов составило 157,6 мг/см3 (Таблица № 4). Сульфат-ионами, как правило, обогащены болотные воды, то есть можно предположить, что в скором будущем пруд может превратиться в болото.
2.2.6. Определение содержания хлорид-иона титрованием азотнокислым серебром.
Метод основан на осаждении хлорид-иона в нейтральной или слабощелочной среде азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора. После осаждения хлорида серебра в точке эквивалентности образуется хромовокислое серебро, при этом желтая окраска раствора переходит в оранжево-желтую. Точность метода 1-3 мг/дм3
Определение содержания хлорид-иона в питьевой воде проводят:
- при содержании хлорид-иона от 10 мг/дм3 и выше титрованием азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора;
- при содержании хлорид-иона до 10 мг/дм3 титрованием азотнокислой ртутью в присутствии индикатора дифенилкарбазона.
Мы же проводили титрованием азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора.
Средства измерений, вспомогательные устройства, реактивы, материалы и растворы.
Вода из различных источников, серебро азотнокислое, индикатор - калий
хромовокислый, вода дистиллированная, квасцы алюмокалиевые (алюминий-калий сернокислый), аммиак водный 25%-ный раствор.
Посуда мерная стеклянная лабораторная, вместимостью: пипетки 100, 50 и 10 см3 без делений, цилиндр мерный 100 см3, бюретка 25 см3 со стеклянным краном, колбы конические, вместимостью 250 см3
Методика проведения анализа.
1. Качественное определение
В пробирку налили 5 см3 воды и добавили 3 капли 10%-ного раствора азотнокислого серебра. Примерное содержание хлорид-иона определяли по осадку или мути в соответствии с требованиями таблицы.
Характеристика осадка или мути
Содержание хлорид-иона, мг/см3
1 Опалесценция или слабая муть
1-10
2 Сильная муть
10-50
3. Образуется хлопья, осаждаются не сразу
50-100
4. Белый объемный осадок
более 100
В результате в пробирке образовывались хлопья, поэтому мы сделали вывод, что содержание хлорид-иона составляет 50-100 мг/см3.
Реакция протекает по уравнению:
NaCI + AgNO3 =Na NO3 +AgCI↓
Для того чтобы в осадок не выпадали одновременно углекислые и фосфорно-кислые соли, последние растворяют прибавлением азотной кислоты.
2.Количественное определение.
Отобрали 20 см3 испытуемой воды и довели до 100см3 дистиллированнойводой. Если вода мутная - то необходимо профильтровать. При цветности воды
выше 30о, пробу обесцвечивают добавлением гидроокиси алюминия. Для этого к 200см3 пробы добавляют 6 см3 суспензии гидроокиси алюминия, встряхивают до обесцвечивания жидкости. Первые порции фильтрата отбрасывают. Отмеренный объем воды вносили в 2 конические колбы и прибавляли по 1 см3 хромовокислого калия. Одну пробу титровали раствором азотнокислым серебром до появления слабого оранжевого оттенка, вторую пробу использовали в качестве контрольной пробы.
Определению мешают ортофосфаты в концентрации, превышающие 25 мг/см3; железо концентрацией более10 мг/см3. Бромиды и иодиды определяются в концентрациях, эквивалентных хлор-иону.
Обработка результатов, измерений.
Содержание хлорид-иона (Х), мг/см3, вычисляли по формуле:
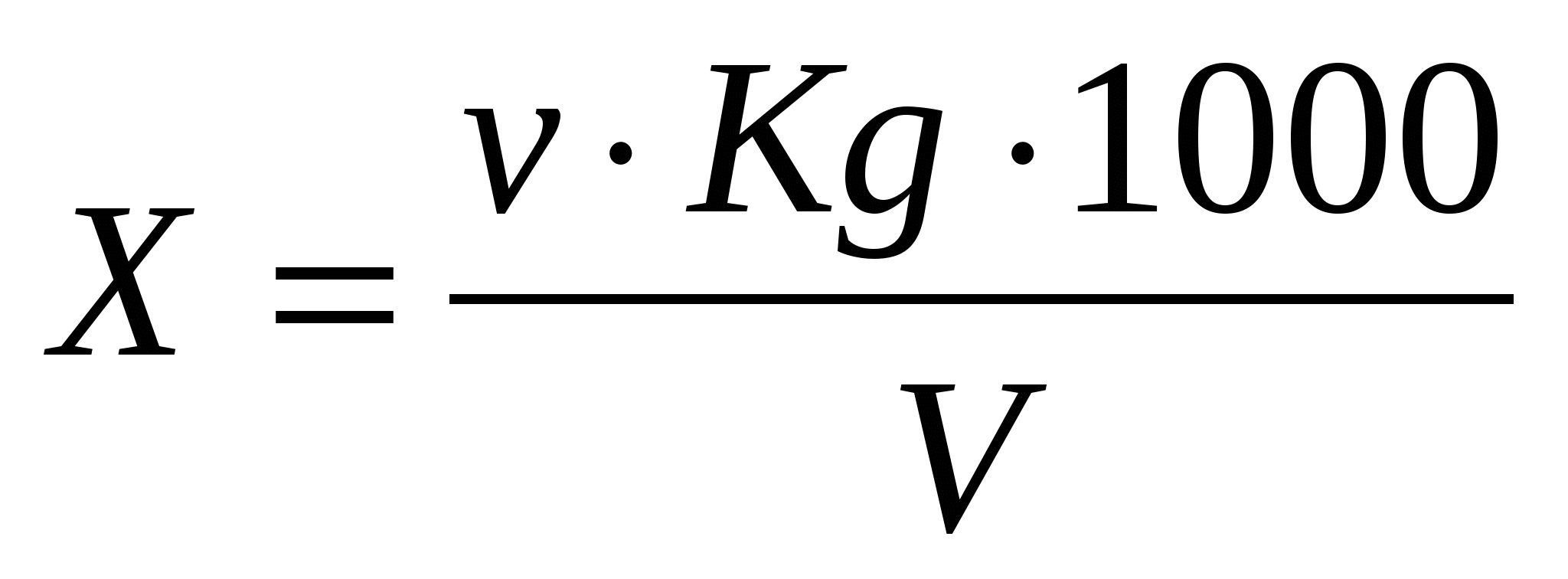 ,
,
где: v - количество азотнокислого серебра, израсходованное на титрование, см3;
K - поправочный коэффициент к титру раствора нитрата серебра;
g - 0,5 - количество хлорид-иона, соответствующая 1 см3 раствора азотнокислого серебра, мг ;
V - объем пробы, взятой для определения, см3.
Расхождения между результатами повторных определений при содержании Cl-иона от 20 до 200 мг/дм3 - 2 мг/дм3; при более высоком содержании - 2 отн. %
Например, на титрование воды пошло нитрата серебра 2,9 мл, тогда
X=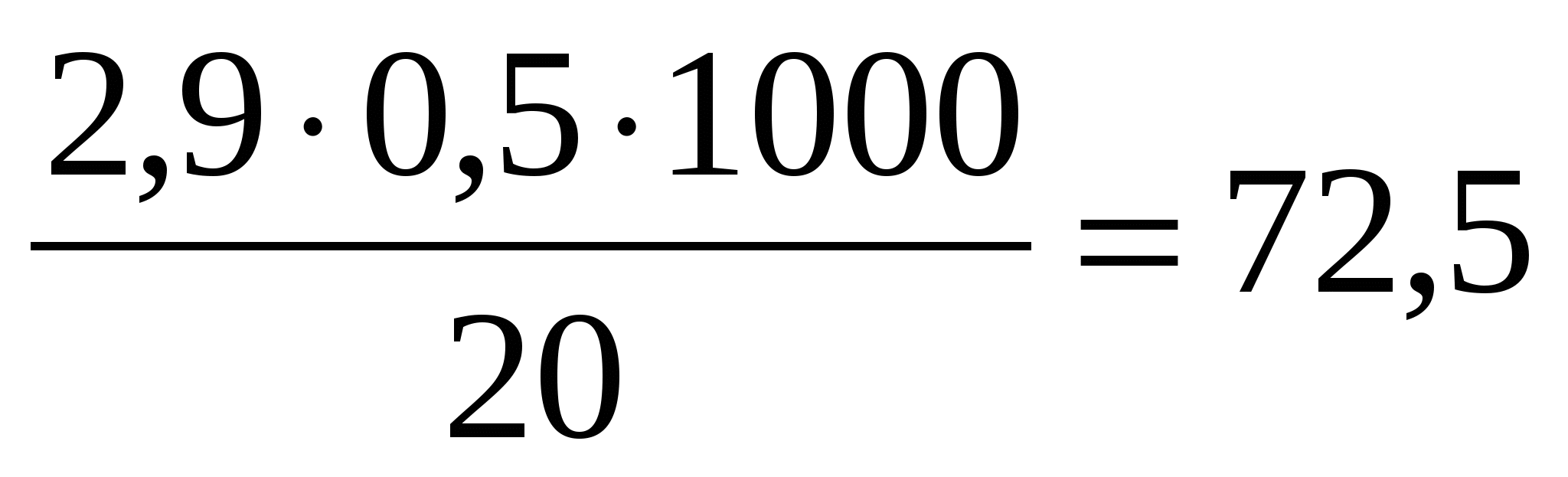 мг/см3
мг/см3
Среднее значение хлорид-ионов составило 76 мг/см3 (Таблица № 4).
Реакция протекает по уравнению:
AgNO3 +KCrO4 = AgCrO4 + KNO3
2.3. Обобщение и выводы.
В ходе нашего научного исследования проведен анализ литературных источников по выбранной теме. Аналитическая химия представляет собой предмет очень важный для экологической химии, однако анализ не лишен специфических недостатков. Одним из примеров может служить тот факт, что для анализа обычно отбирают чрезвычайно малую пробу, которая почти всегда является смесью веществ, способных взаимодействовать друг с другом. Кроме того, анализ следовых количеств одного вещества проводится в бесконечно большом объеме воздуха, воды или сточных вод.(1,21), тем не менее, анализы были проведены (в количестве 5 - определение жесткости воды, 5 - определение окисляемости, 5 - определение хлоридов и сульфат-ионов, 5- определение аммиака.) и вычислено среднее значение (таблица № 4). По полученным данным можно сделать следующие выводы:
показатели
Результаты, полученные в ходе исследования
П.Д.К.
Жесткость воды
(мг-экв/л)
11,4 мг-экв/л
7 мг-экв/л
Ионы кальция
209,8 мг/л
-
Ионы магния
157,6 мг/л
50 мг/л
«Окисляемость»
37,94 мгО/л
5 мгО/л
Содержание аммиака
9 мг/л
1,5 мг/л
Сульфат-ионы
157,6 мг/см3
250 мг/дм3
Хлорид-ионы
76 мг/см3
250 мг/дм3
Запах
болотный
2 балла
Прозрачность
5см
Вкус
солоноватый
2 балла
Реакция
рН=8,5
рН = 6-9
Мы были удивлены тем, что содержание сульфат-ионов и хлорид-ионов в пруду соответствует норме. И, хотя содержание данных ионов соответствует норме, все-таки оно выше, чем в питьевой воде городов, где проводится очистка воды. Сульфат-ионами, как правило, обогащены болотные воды, т.е можно предположить, что в скором будущем наш пруд может превратиться в болото.(9) «Окисляемость» превышает норму в 7,5 раз. Вода жесткая, имеет неприятный запах и вкус, цвет желто-зеленоватый, повышенное содержание аммиака.
Заключение.
Великий исследователь гидросферы В.И. Вернадский писал «Все природные воды, где бы они не находились, теснейшим образом связаны между собой и представляют единое целое». То есть, как было сказано в предыдущих работах: главное свойство воды - ее единство. Суть этого единства заключается в том, что все, что происходит с природной водой в каком-нибудь одном месте, отражается на воде в других местах. Вода из нашего пруда питает реку Стерля, а Стерля - реку Белая. Об этом должен помнить каждый гражданин.
На наш взгляд, предлагаемые аналитические исследования не только дадут возможность задуматься над важностью экологических проблем, но и помогут осознать роль человека в их решении, потому что все природные воды, где бы они не находились, теснейшим образом связаны между собой и представляют единое целое.
Убедились в том, что вопрос сохранения питьевой воды остается актуальным для жителей нашей деревни. Так как основным источником загрязнения и изменения химического состава воды является практическая деятельность человека. (фото №1, №2). Большинство наших односельчан сбрасывает в пруд бытовой мусор, туда же весной тракторами сталкиваются навозные кучи.
Участвуя в исследовательском проекте, мы поняли, что проблема чистой воды пруда является жизненно важной. Когда-то пруд был не только украшением нашей деревни, но и источником воды. Кроме того, наши родители рассказывали нам как весело было проводить время на рыбалке. Сколько радостей им приносило купание. Что же мы наблюдаем сейчас?
Наш пруд серьезно болен и медленно умирает. Но в наших силах вернуть и сохранить былую красоту: посредством агитации, бесед, листовок с оглашением результатов нашей работы повлиять на жителей деревни. Для этого подготовили и провели такие мероприятия:
-
Акция "Чистый берег"; ( фото №)
-
Час экологической грамотности;
-
Подготовка агитбригады к выступлению перед местными жителями "Используй, охраняя, и охраняй, используя";
-
"Будущее человечества" - защита реферата.
-
"Экологическая азбука" для учащихся начальной школы;
-
"Экологическая сказка" - мероприятие для учащихся начальных классов;
-
Выпуск стенгазеты "Живая вода";
-
Подворный обход с агитацией;
-
Выпуск листовок.
В этом году мы планируем продолжить изучение изменения химического состава воды пруда, в том числе содержание нитратов и фосфатов, повышенное содержание которых вызывает эвтрофикацию, т.е. насыщение питательными веществами.
Расширив свой кругозор, мы получили новые знания и приобщились к экологической культуре, тем самым, понимая ценности жизни и формируя личностное мировоззрение. .
Литература.
1. Под редакцией О. М. Бокриса. Химия окружающей среды. Москва «Химия», 1982г, стр. 21.
2. Под редакцией Гольдфельда М. Г «Химия и общество» Москва, «мир», 1995 г, стр.80.
3. А.И. Гурова, О.Е.Горлова Практикум по общей гигиене.
4.Тайны воды. Виктор Калашников. Белый город. Москва, 2004 .
5.Константинов В.М. Охрана природы, Москва «Академия» 2000 г, стр. 90.
6.У. Слейбо, Т. Персонс. Общая химия. Москва 1979, стр. 506-510.
7..Под редакцией Лидина А. А. «Химия. Справочник школьника и студента». Москва «Дрофа», 1999 г, стр. 315
8.Под редакцией Павлова Н.Н., Фролова В.И. «Практикум по общей и неорганической химии». Москва «Дрофа», 2002г, стр. 265.
9.Хисматов В.Ф., Сухов В.П. География Башкортостана 9 класс. Уфа: Китап, 2000 г., стр. 35.
10.Л Хохлова. Особенности формирования химического состава воды в водотоках, расположенных в зоне трасы газопровода. Статья.
11.Статьи из Интернета: «К вопросу о пригодности воды для питья», «Наиболее полезные и вредные свойства воды»
12.Я познаю мир. Химия. «Издательство Астрель», 2003 год, стр.52.
Таблица № 1. Шкала интенсивности запаха и привкуса питьевой воды.
Балл
интенсивность
запаха
или привкуса.
Характеристика интенсивности.
0
Нет
Отсутствие ощущения запаха и привкуса
1
Очень слабая
Запах или привкус, не поддающийся обнаружению, но определяемый в лаборатории опытным аналитиком
2
Слабая
Запах или привкус, привлекающий внимания потребителя, который можно обнаружить, если обратить на него внимание
3
Заметная
Запах или привкус, легко обнаруживаемый и дающий повод относиться к воде неодобрительно
4
Отчетливая
Запах или привкус, обращающий внимание и делающий воду неприятной для питья
5
Очень сильная
Запах или привкус настолько сильный, что делает воду непригодной для питья
Таблица № 2. Шкала для определения цветности воды.
номер цилиндра
количество основного раствора, мл
подкисленная дистиллированная вода, мл
Цветность, град.
1
0
100
0
2
1
99
5
3
2
98
10
4
3
97
15
5
4
96
20
6
5
95
25
7
6
94
30
8
8
92
40
9
10
90
50
10
12
88
60
11
14
86
70
12
16
84
80
Таблица №3. Ориентировочное содержание аммиака в воде
Окрашивание при
рассматривании пробирки сбоку
Окрашивание при рассматривании пробирки сверху
содержание аммиака
мг/л
Нет
Нет
Менее 0,05
Нет
Чрезвычайно слабое, желтоватое
0,1
Черезвычайно слабое, желтоватое
Слабо-желтоватое
0,25
Очень слабо-желтое
Желтоватое
0,5
Слабо желтоватое
Светло-желтое
1,0
Светло желтоватое
Желтое
2,5
Желтое
Интенсивно-желто-буроватое
5,0
Мутное, резко-желтое
Мутное, бурое
10,0
Мутное, бурое
Мутное, интенсивно-бурое
25,0
Таблица № 4. Сравнительная таблица.
жесткость
воды (мг-экв/л)
ионы кальция
(мг/л)
ионы магния (мг/л)
хлорид-ионы (мг/дм3)
сульфат-ионы (мг/дм3)
окисляемость
(мгО/л)
наличие аммиака
(мг/л)
1
10,75
237
176
76
164,2
39,8
10
2
11,5
186
154
74,8
175,6
35,6
5,0
3
12,05
210
162
77,3
161,2
37,5
10
4
11
198
147
75,7
158,2
38,1
10
5
11,75
218
149
76,2
187,3
38,7
10
итого
11,41
209,8
157,6
76
169,3
37,94
9
ПДК
7
-
50
250
250
5
1,5
Фото № !
28


