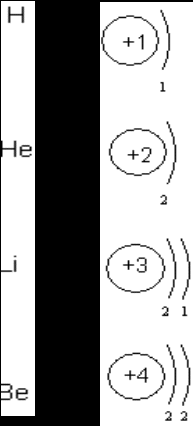
- Преподавателю
- Другое
- Самообразовательная деятельность учащихся при изучении неорганической химии в 8 классе
Самообразовательная деятельность учащихся при изучении неорганической химии в 8 классе
| Раздел | Другое |
| Класс | 8 класс |
| Тип | Другие методич. материалы |
| Автор | Загребельная С.Г. |
| Дата | 19.02.2015 |
| Формат | doc |
| Изображения | Есть |
Самообразовательная деятельность учащихся при изучении
неорганической химии в 8 классе
(подача материала блоками).
В современной школе используется много разнообразных технологий, методов, приемов, но конечная цель одна: дать учащимся определенные знания; наилучшим образом научить определенным навыкам и умениям; создать надлежащий уровень компетентностей по предмету. Предлагаемый материал предполагает использование технологических опорных схем для изучения химии большими блочными единицами. Опорные схемы можно использовать как индивидуальный дидактический материал для каждого учащегося или группы учащихся или с применением ИКТ (приложение № 1, презентации к опорным схемам). Технология использования опорных схем позволяет выполнять следующие задачи современной школы:
-
формирование навыков самостоятельной деятельности учащихся;
-
обучение учащихся работе с учебником, дополнительной литературой и другими источниками информации;
-
формирование общеучебных психологических качеств личности: умение выделять главное, использовать дедуктивные и индуктивные способы мышления, обобщать, устанавливать причинно-следственные связи и общие закономерности;
-
систематизация записей в тетрадях-конспектах, что способствует выработке четкости и системности мышления и запоминанию учебной информации;
-
создание «банка» личных записей, которые позволяют быстро найти и вспомнить необходимую информацию;
-
создание дополнительного времени для отработки полученных знаний.
Предлагаемый материал построен по принципу:
-
Информация для учителя (учащегося, который работает самостоятельно) о содержании материала, цели его изучения, технологии работы на уроке и предполагаемые результаты после изучения темы.
-
Закрытая схема, которая предусматривает организацию работы учащихся, возможность создания проблемных ситуаций. В этих схемах, чаще всего, в открытой форме подается только тот материал, который не предусматривает базовых знаний или являет собой ключевые слова для понимания или показывает учащимся, что в конкретном случае от них требуется.
-
Открытая схема, в которой курсивом написано то, что должно появиться после заполнения на уроке или в результате самостоятельной работы. В классах с низким уровнем познавательной активности учитель может сразу предложить открытую форму и с ее помощью сориентировать учащихся в новом материале. Открытые опорные схемы отражены в презентации (приложение № 1).
Применение элементов этой технологии помогает учащимся лучше ориентироваться в предмете, они легко находят необходимую им информацию, не боятся повторения, в 11 классе легко возобновляют свои знания по неорганической химии. Учащиеся старших классов способны использовать полученные навыки составления схем и на других предметах.
Тема. Первоначальные химические понятия.
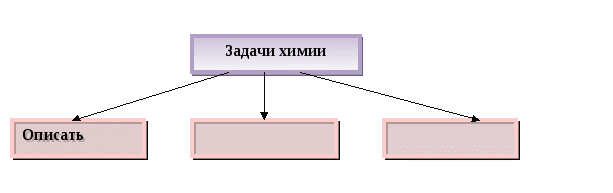
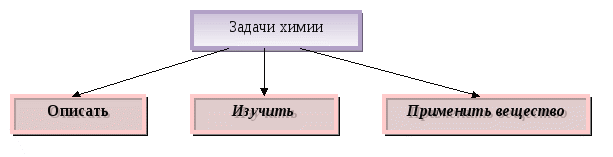
Содержание материала. Предмет химии. Задачи химии. Понятия «вещество» и «тело». Свойства веществ. Понятие «смесь». Виды смесей. Способы разделения смесей.
Технология работы с опорной схемой: заполняется на одном или в течении нескольких уроков, на усмотрение учителя, в зависимости от учебной нагрузки на каждом уроке.
Вариант 1. Опорная схема, в целом изображенная на листе, раздается на каждый стол или каждому учащемуся, но внимание на ней не акцентируется. Учитель преподает материал, обговаривая те или иные понятия, и по мере формулирования выводов (учителем или учащимися, в зависимости от уровня познавательной активности класса), опорная схема заполняется прямо на распечатанном листе или в тетрадях учащихся.
Вариант 2. Учитель показывает опорную схему в начале урока и создает проблемную ситуацию, которая вызывает в учащихся необходимость найти правильные ответы и вставить их по смыслу в пустые места на схеме. Учащиеся самостоятельно или в парах, возможно, в группах по четыре человека, пытаются заполнить пустые места в схеме, используя учебник и свои знания (заполнение выполняется карандашом). А потом коллективно, вместе с учителем обговаривая те или иные вопросы, приходят к правильным выводам и, по необходимости, исправляют ошибки.
Обучающие цели: научить выделять главное и формулировать понятия и характеристики кратко, используя лишь ключевые слова; научить составлять краткий конспект, который базируется на логическом построении большого объема учебного материала; создать условия для повторения материала, по необходимости, за короткий промежуток времени.
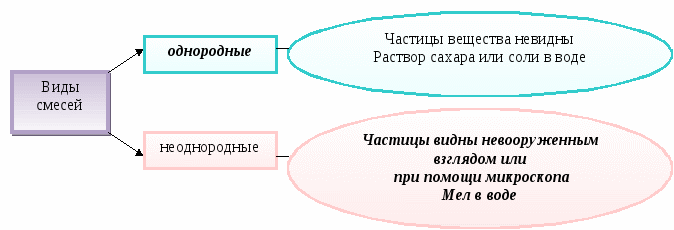
Дидактические цели: сформулировать представление о химии, как о науке, имеющей много разных направлений и задач; уточнить представления учащихся о веществе и физическом теле; определить совокупность характеристик вещества, которые составляют понятия «физические и химические свойства»; дать понятие «смесь» и пояснить особенности и свойства однородных и неоднородных смесей; познакомить со способами разделения смесей и научить учащихся, используя знания о составе смеси, разделять их на составляющие.
Ожидаемый результат. Вследствие работы с опорной схемой на уроке, при повторении дома и перед началом следующего урока учащиеся должны усвоить тот минимум обязательных знаний, который позволит им выполнять задания по этой теме: выделять среди совокупности понятий тело и вещество, описывать физические свойства вещества, определять вид смеси по ее характеристикам, предлагать способы разделения смеси, исходя из ее состава и свойств веществ, входящих в состав этой смеси.
Ниже приводится «закрытый» и один из вариантов «открытой» опорной схемы по теме.
Тема. Первоначальные химические понятия.
Химия - наука о ______________________________________________________________
Физическое тело - это ___________________________________________________________
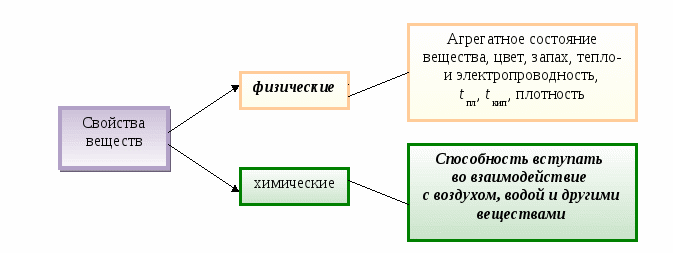
Вещество - это _________________________________________________________________
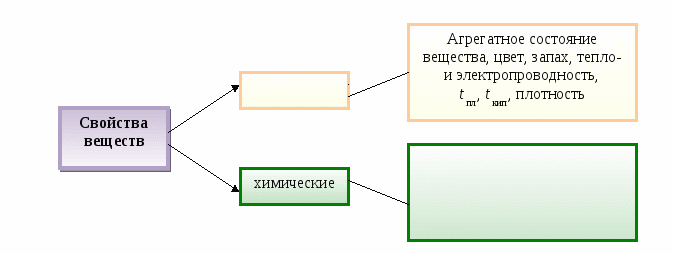
Свойства веществ - это __________________________________________________________
Вещества в природе находятся в виде _______________________________________________
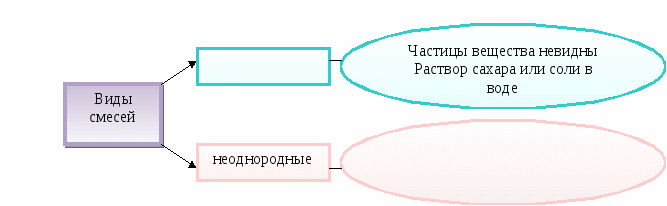
Смесь - это _____________________________________________________________________
Чистое вещество - это ____________________________________________________________
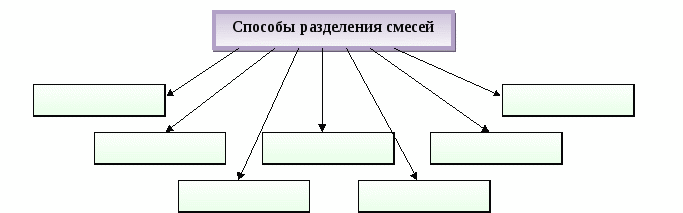
Способы разделения смесей основаны на __________ веществ, входящих в состав смеси.
Тема. Первоначальные химические понятия.
Химия - наука о веществах, их свойствах и превращениях.
Физическое тело - это объект, имеющий форму (предмет окружающего мира).
Вещество - это то, из чего состоят физические тела.
Свойства веществ - это признаки, по которым одни вещества отличаются от других.
Вещества в природе находятся в виде смесей.
Смесь - это совокупность индивидуальных веществ (у смеси непостоянный состав и свойства).
Чистое вещество - это вещество, обладающее постоянными физическими свойствами.
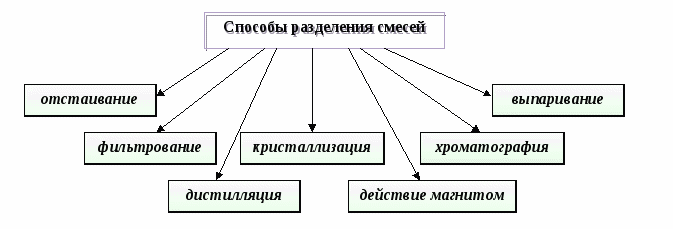
Способы разделения смесей основаны на свойствах веществ, входящих в состав смеси.
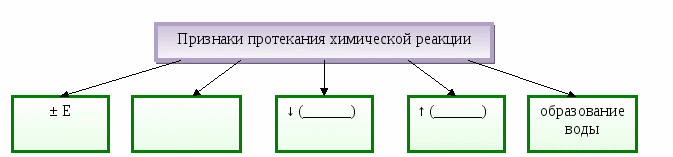
Тема. Явления физические и химические.
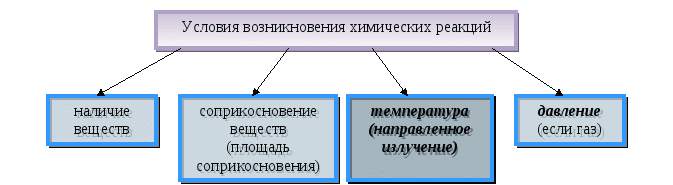
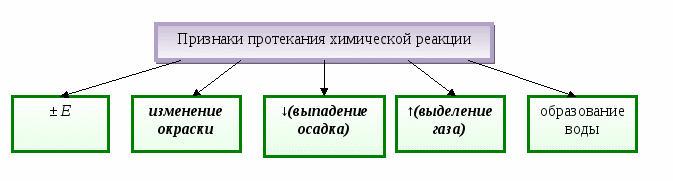
Содержание материала. Явления физические и химические. Химическая реакция. Признаки химической реакции, условия ее возникновения и протекания.
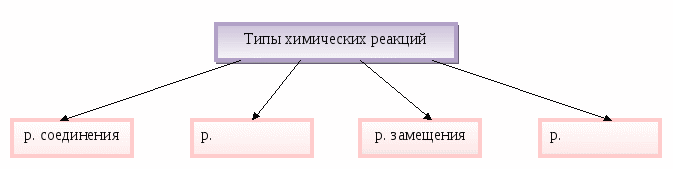
Технология работы с опорной схемой. Заполняется на одном уроке. Типы химических реакций учителю по желанию можно оставить для заполнения в теме «Химические реакции», или сделать это на этом уроке, а теме «Химические реакции» повторить типы реакций как уже знакомый материал.
Вариант 1. Опорная схема, в целом изображается на листе, раздается на каждый стол или каждому учащемуся, но внимание на ней не акцентируется. Учитель преподает материал, обговаривая те или иные понятия, и по мере формулирования выводов (учителем или учащимися, в зависимости от уровня познавательной активности класса), опорная схема заполняется прямо на распечатанном листе или в тетрадях учащихся.
Вариант 2. Учитель показывает опорную схему в начале урока и создает проблемную ситуацию, которая вызывает в учащихся необходимость найти правильные ответы и вставить их по смыслу в пустые места на схеме. Учащиеся самостоятельно или в парах, возможно, в группах по четыре человека, пытаются заполнить пустые места в схеме, используя учебник и свои знания (заполнение выполняется карандашом). А потом коллективно, вместе с учителем обговаривая те или иные вопросы, приходят к правильным выводам и, по необходимости, исправляют ошибки.
Обучающие цели: научить выделять главное; формулировать понятия и характеристики кратко, используя лишь ключевые слова; научить составлять краткий конспект, который базируется на логическом построении большого объема учебного материала; создать условия для повторения материала, по необходимости, за короткий промежуток времени; формировать коммуникативные навыки, которые способствуют развитию умений работать в группе, вести дискуссию, отстаивать точку зрения.
Дидактические цели: изучить понятия «химические явления» (реакции), «физические явления»; выяснить условия возникновения и протекания химических реакций; изучить и показать признаки химических реакций.
Результат: значительно меньше времени тратится на запись формулировок, что позволяет больше внимания уделить демонстрационным опытам и в значительной степени повышает познавательный интерес учащихся.
Ниже приводится «закрытый» и один из вариантов «открытой» опорной схемы по теме.
Тема. Явления физические и химические.
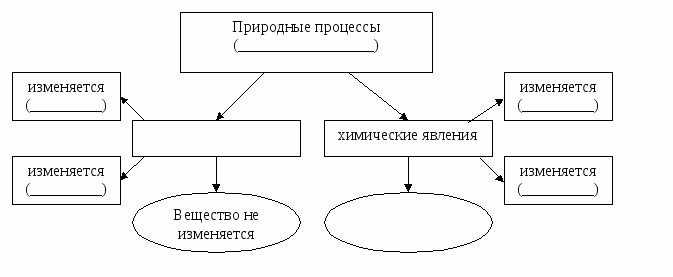
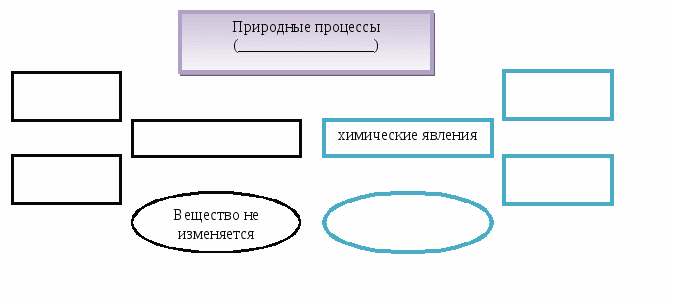

Химические явления = химические реакции 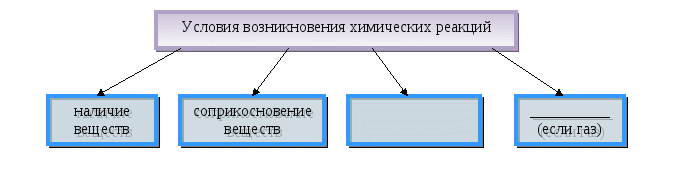
 Запись реакции
Запись реакции
Исходные вещества ______ реакции
А + В → С + D схема реакции
А + В = С + D ________ реакции
________________ АВ → А + В _______________ АВ + СD → АD + СВ
2Са + О2 → 2СаО _______________ Zn +2HCl → ZnCl2+ H2 ________________
CaO + H2O → Ca(OH) 2
Тема. Явления физические и химические.
Химические явления = химические реакции

-
Запись реакции
Исходные вещества продукты реакции
А + В → С + D схема реакции
А + В = С + D уравнение реакции
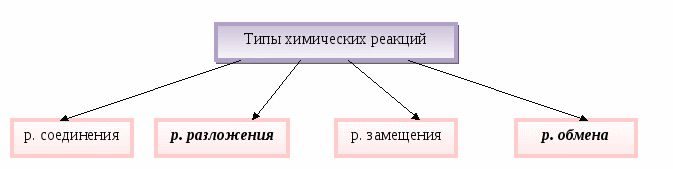
А + В → АВ АВ → А + В А + ВС → АС + В АВ + СD → АD + СВ
2Са + О2 → 2СаО СаСО3→ СаО +СО2 Zn +2HCl → ZnCl2+ H2NaOH +НCl→ NaCl+ H2O
CaO + H2O → Ca(OH)2
Тема. Строение вещества.
Содержание материала. Химический элемент. Молекулярное и немолекулярное строение вещества. Молекулы как мельчайшие частички вещества, определяющие его химические свойства. Атомы как мельчайшие частички вещества. Простые и сложные вещества. Химическая формула, индексы и коэффициенты.
Технология работы с опорной схемой. Заполняется на одном или в течении нескольких уроков, на усмотрение учителя, в зависимости от учебной нагрузки на каждом уроке. В связи с тем, что учащиеся уже знакомы с атомно-молекулярным учением из курса физики, это в значительной мере увеличивает темп урока и облегчает работу учителя при объяснении нового материала.
Обучающие цели: научить выделять главное и формулировать понятия и характеристики кратко, используя лишь ключевые слова; реализовать возможность осуществления межпредметных связей; научить составлять краткий конспект, который базируется на логическом построении большого объема учебного материала; создать условия для повторения материала, по необходимости, за короткий промежуток времени; формировать коммуникативные навыки, которые способствуют развитию умений работать в группе, вести дискуссию, отстаивать точку зрения; формировать у школьников химическое видение окружающего мира
Дидактические цели: используя полученные учащимися знания о строении вещества из курса физики, систематизировать представления об атомах и молекулах, ввести представление о химическом элементе, как атоме определенного вида, о химической формуле, как условной записи состава вещества, простых и сложных веществах; научить школьников, используя полученные знания, давать характеристику веществ по формуле; показать взаимосвязь между химией и физикой.
Результат. Увеличивается время для изучения новых понятий и отработки умений и навыков во время работы с химическими формулами, развивается логическое мышление, повышается роль ученика как соучастника процесса обучения и получения новых знаний, что создает атмосферу заинтересованности во время изучения нового материала; при этом уменьшается страх детей перед достаточно сложными вопросами, что способствует лучшему усвоению материала.
Ниже приводится «закрытый» и один из вариантов «открытой» опорной схемы по теме.
Тема. Строение вещества.
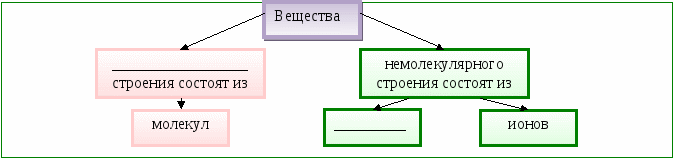
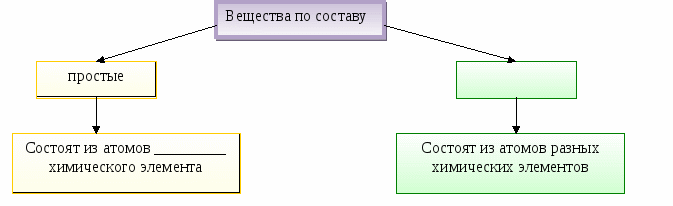
Вещества ____________ строения состоят из __________________________________________
Молекула - мельчайшая частичка ______________, сохраняющая его ______________________
Молекула химически ___________________, физически _________________________________
Молекулы хаотически _____________________________________________________________
Между молекулами существуют ____________________________________________________
Между молекулами действуют силы ______________________ и _________________________
Вещества ____________ строения состоят из __________________________________________
Атом - мельчайшая частичка _______________________________________________________
Атом химически ___________________, физически ____________________________________
Атомы одного вида отличаются от атомов другого вида _______________ и _______________
Совокупность атомов одного вида - это _______________________________________________
_______ - заряженные частицы вещества, образовавшиеся из атомов или группы атомов.
H2, O2, P, S, Al H2O, HNO3, Ca(OH)2
Химическая формула - это __________________________________________________________
Общая запись формулы бинарного вещества
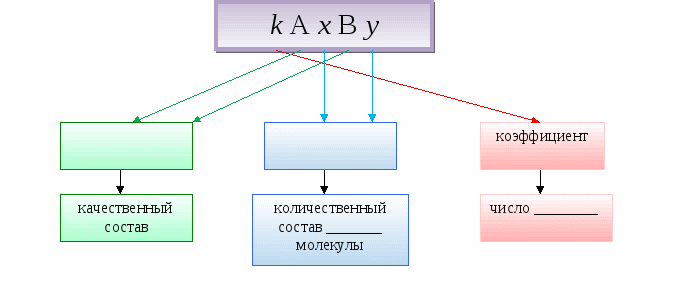
Коэффициент показывает число несоединенных друг с другом частиц (______, ____или ионов).
Н - один ____ водорода. 2Н - ____ атома водорода.
Н + - один ион водорода. 2Н + - два _____ водорода.
H2 - одна _______ водорода. 2H2 - две молекулы водорода.
H2O - ___________ воды. 2H2O - _________ воды.
Тело → ________ → ________ → ________ → _________ → применение
Тема. Строение вещества.
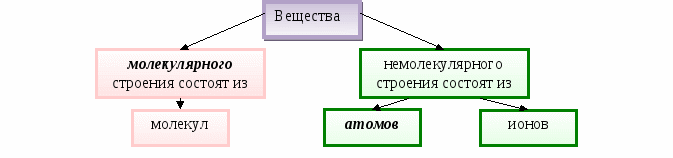
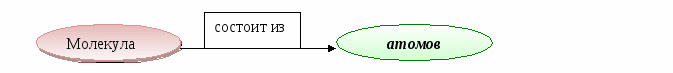
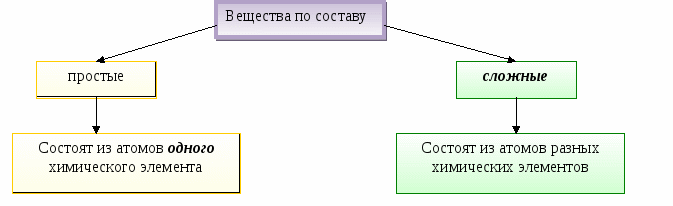
Вещества молекулярного строения состоят из молекул.
Молекула - мельчайшая частица вещества, сохраняющая его свойства.
Молекула химически делима, физически неделима.
Молекулы хаотически движутся.
Между молекулами существуют промежутки.
Между молекулами действуют силы притяжения и отталкивания.
Вещества немолекулярного строения состоят из атомов или ионов.
Атом - мельчайшая частица вещества.
Атом химически неделим, физически делим.
Атомы одного вида отличаются от атомов другого вида размером и массой.
Совокупность атомов одного вида - это химический элемент.
Ионы - заряженные частицы вещества, образовавшиеся из атомов или группы атомов.
H2, O2, P, S, Al H2O, HNO3, Ca(OH)2
Химическая формула - это условная запись состава вещества с помощью химических знаков и индексов.
Общая запись формулы бинарного вещества
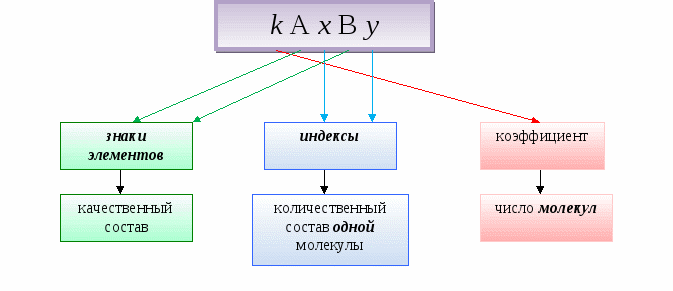
Коэффициент показывает число несоединенных друг с другом частиц (молекул, атомов или ионов).
Н - один атом водорода. 2Н - два атома водорода.
Н + - один ион водорода. 2Н + - два иона водорода.
H2 - одна молекула водорода. 2H2 - две молекулы водорода
H2O - одна молекула воды. 2H2O - две молекулы воды.
Тело → вещество → состав → строение → свойства → применение
Тема. Количественные отношения в химии.
Содержание материала. Понятие о физической величине, количество вещества; моль - единица количества вещества; постоянная Авогадро; молярная масса; закон Авогадро; молярный объем; относительная плотность газов; плотность газов; вычисления по уравнениям, в которых участвуют газообразные вещества.
Технология работы с опорной схемой. Заполнение опорной схемы осуществляется частями. Первая часть - при изучении количества вещества, вторая - после изучения уравнений реакций, при решении задач по уравнениям реакций, в которых участвуют газы.
Обучающие цели: научить выделять главное и формулировать понятия и характеристики кратко, используя лишь ключевые слова; учить школьников использовать математические навыки для решения химических задач; научить составлять краткий конспект, который базируется на логическом построении большого объема учебного материала; создать условия для повторения материала, по необходимости, за короткий промежуток времени.
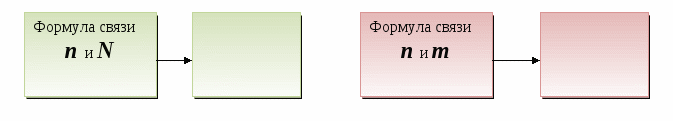
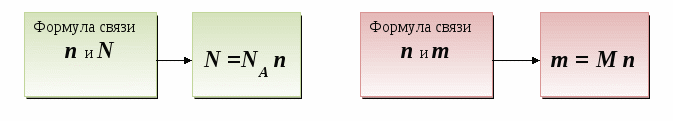
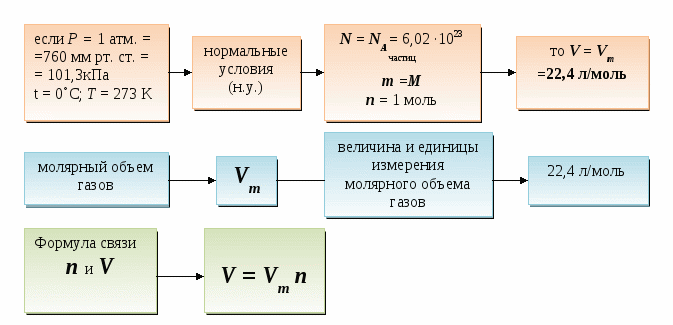
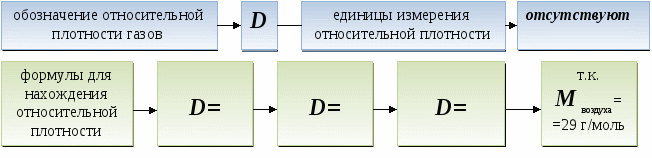
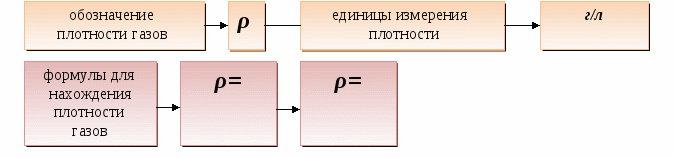
Дидактические цели: ввести новую физическую величину «количество вещества», охарактеризовать его единицу измерения - моль; объяснить значение и физический смысл постоянной Авогадро; ввести понятие «молекулярная масса» и сравнить ее значение с относительной молекулярной массой; показать взаимосвязь между количеством вещества, массой вещества и количеством частиц; ввести представление о законе Авогадро и понятии «нормальные условия»; ввести понятие «молярный объем газов», «плотность газов», «относительная плотность газов»; показать способы применения закона Авогадро для решения задач, в которых принимают участие газообразные вещества.
Результат. Учащиеся сразу определяют основные величины, формулы, необходимые им для решения задач, быстро устанавливают общность понятий и закономерностей, которые выводятся из них математически, легко справляются с поиском необходимых вычислительных данных. Высвобождается учебное время для решения задач.
Ниже приводится «закрытый» и один из вариантов «открытой» опорной схемы по описанной теме и многовариантная задача, позволяющая качественно отработать полученные знания на практике.
Тема. Количественные отношения в химии.
Количество вещества - это ____________ величина, которая показывает число _______________ (атомов, молекул или ионов), содержащихся в определенном веществе.
Количество любого вещества величиной ______ содержит _______ структурных частиц (атомов, молекул или ионов), т. е. равно числу _________.
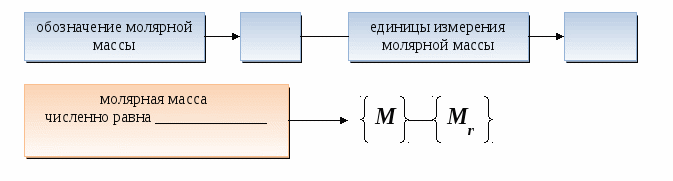
Молярная масса любого вещества - это масса в граммах вещества, взятого количеством _______
Закон Авогадро: в ______ объемах ______ газов при ________ условиях содержится ________
число частиц.
А это означает, если P = const, T = const, V = const, n = const, то для всех газов N = const.
Следствия из закона Авогадро.
1.
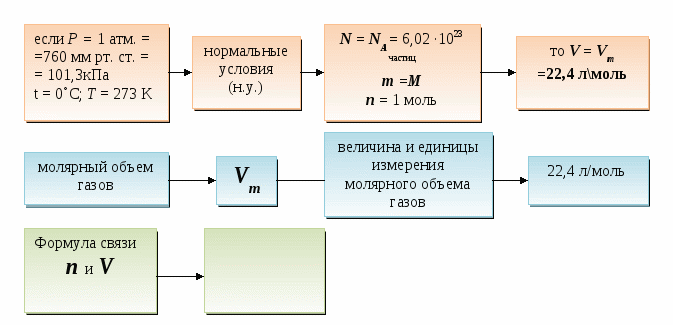
Молярный объем - это объем _________ любого газа.
2.
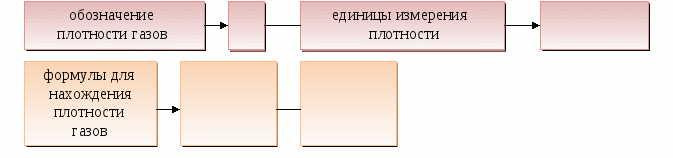
Относительную плотность одного газа по другому можно рассматривать как отношение их
молярных масс.
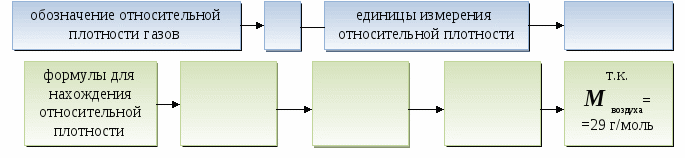
Для сравнения: плотность - ______ 1 л газа.
3.
Если взаимодействуют газообразные и вещества, то соотношение их объемов равняется соотношению их _____________ в уравнении реакции (при неизменном давлении газов).
Для реакции aА + bВ = cС соотношение может иметь вид:
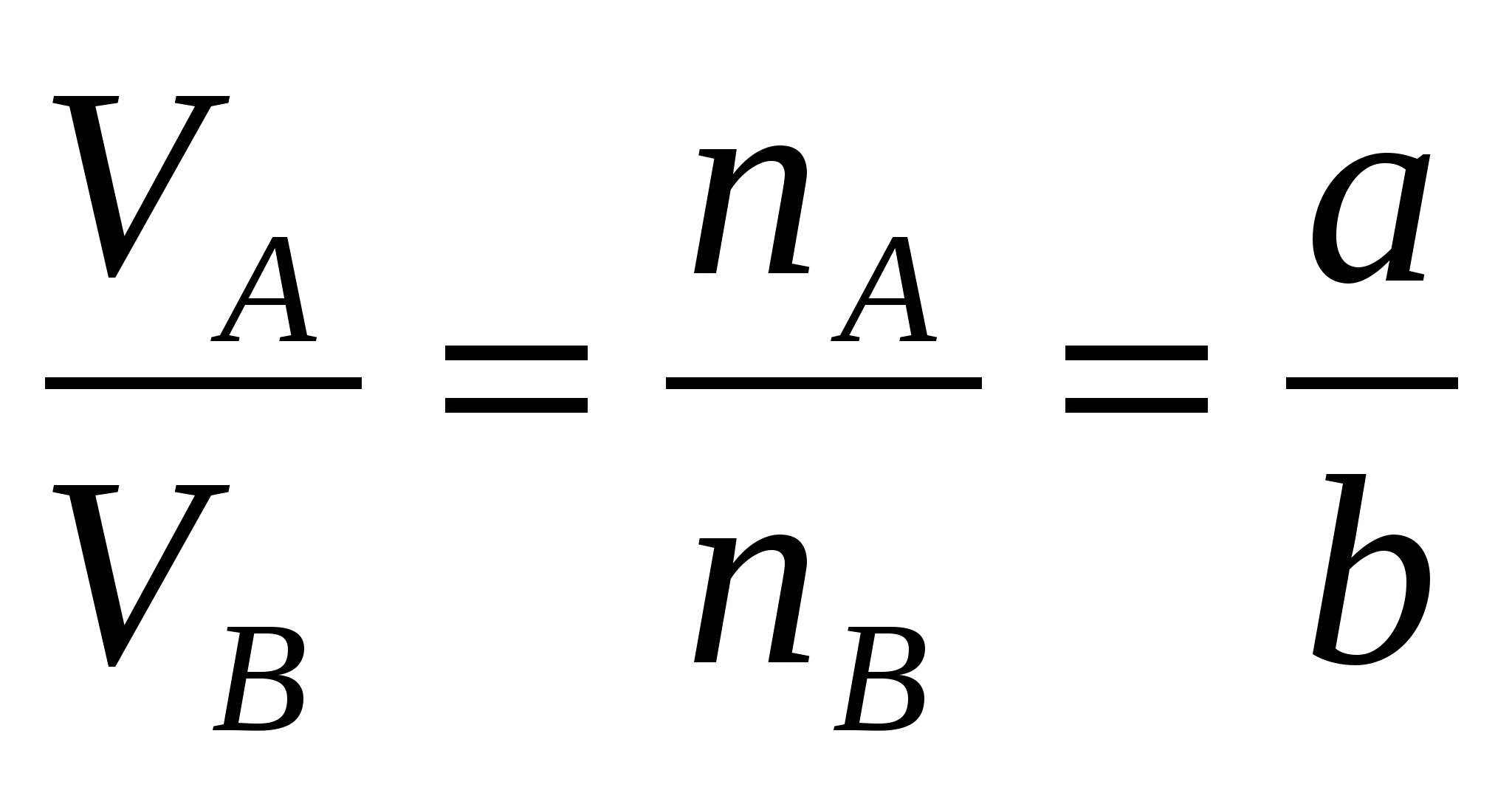
Многовариантная проверочная работа по теме «Количество вещества».
Вари-
ант
Формула
М
(г/моль)
n
(моль)
m
(г)
V
(л)
N
(молекул)
ρ
(г/л)
D по водороду
D по воздуху
1
HF
0,5
2
SiH4
8
3
O3
1,12
4
C2H6
1,5
5
HBr
3,01 ·1024
6
SO2
6,4
7
NH3
2
8
CH4
2,8
9
CO2
1,505 ·1022
10
H2S
3
11
C3H8
11
12
HI
8,96
13
NO
2,5
14
HCl
6,02 ·1021
15
N2O
112
16
C2H2
7,8
17
Cl2
0,2
18
NO2
1,204 ·1022
19
C2H4
4,48
20
C4H10
11,6
Тема. Количественные отношения в химии.
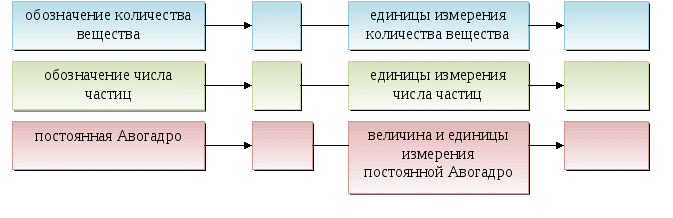
Количество вещества - это физико-химическая величина, которая показывает число структурных частиц (атомов, молекул или ионов), содержащихся в определенном веществе.
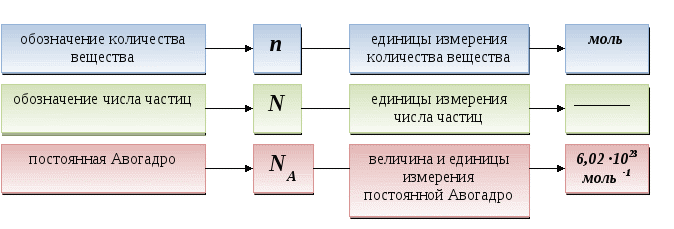
Количество любого вещества величиной 1моль содержит 6,02 ·1023 структурных частиц (атомов, молекул или ионов), т. е. равно числу Авогадро.
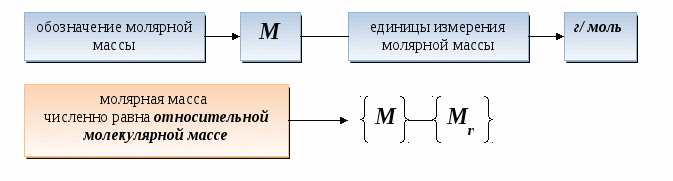
Молярная масса любого вещества - это масса в граммах вещества, взятого количеством 1 моль.
Закон Авогадро: в равных объемах различных газов при одинаковых условиях содержится одинаковое число частиц.
А это означает, если P = const, T = const, V = const, n = const, то для всех газов N = const.
Следствия из закона Авогадро:
1.
Молярный объем - это объем 1 моль любого газа.
2.
Относительную плотность одного газа по другому можно рассматривать как отношение их молярных масс.
Для сравнения: плотность - масса 1 л газа.
3.
Если взаимодействуют газообразные и вещества, то соотношение их объемов равняется соотношению их коэффициентов в уравнении реакции (при неизменном давлении газов).
Для реакции aА + bВ = cС соотношение может иметь вид:
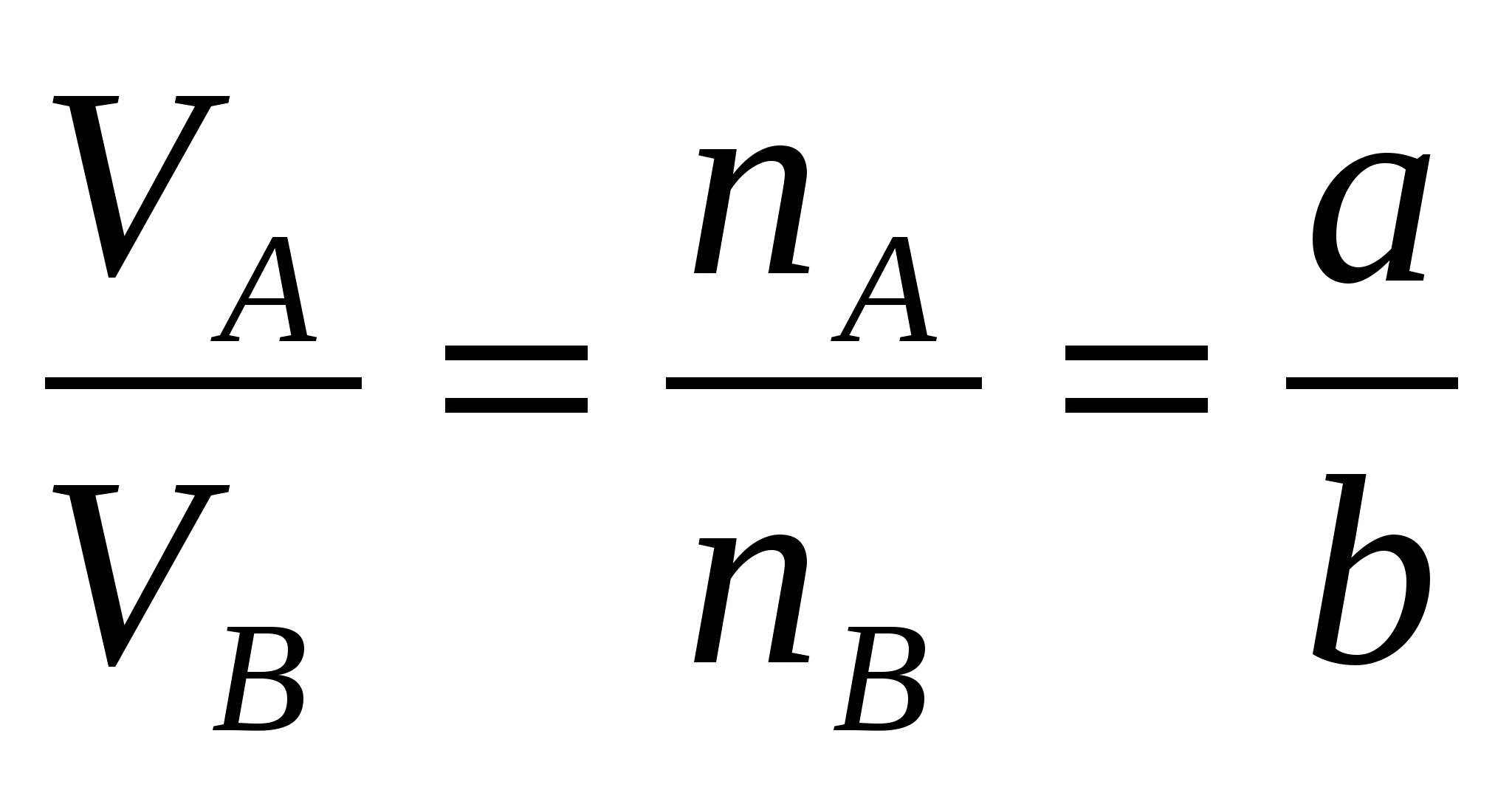
Тема. Периодический закон.
Периодическая система Д.И. Менделеева.
Содержание материала. Строение современной таблицы. Периоды и группы. Малые и большие периоды, главные и побочные подгруппы (А и Б подгруппы). Формулировка периодического закона. Связь между современными представлениями о строении атома и структурой периодической системы. Понятия «металличность » и «неметалличность» и их связь со строением атома.
Технология работы с опорной схемой. Заполняется в течении нескольких уроков, на усмотрение учителя. Обычно, первая часть на первом уроке, вторая - после изучения строения атома. Для работы с опорной схемой учащиеся используют периодическую систему.
Обучающие цели: обучить работать со справочным материалом, делать выводы и выделять главное; продолжить формирование умений составлять краткий конспект, который базируется на логическом построении большого объема учебного материала; создать условия для повторения материала, по необходимости, за короткий промежуток времени; формировать коммуникативные навыки.
Дидактические цели: обучить учащихся воспринимать таблицу Д.И. Менделеева как «шпаргалку», с помощью которой всегда можно получить большое количество разнообразной информации о химических элементах; формулировать понимание периодического закона как общего закона; ввести понятия «порядковый номер», «период», «группа» и связать их с современными представлениями о строении атома; сформировать умение предвидеть характер элемента и его основные свойства на основе положения в таблице.
Результат: учащиеся легко ориентируются в таблице, понимая, что положение элемента в таблице влияют на свойства простого вещества и его соединений, устанавливают закономерности изменения свойств в периодах и группах, формируется взаимосвязь между строением атома и таблицей, что, в дальнейшем, создает хорошую базу для понимания строения вещества.
Рекомендации. Предлагаемую опорную схему лучше показать учащимся не в начале урока, а после того, как учитель ввел представление о таблице и вместе с учащимися проследил основные закономерности. Т. о. учащиеся заполняют первую часть осмыслено и вполне самостоятельно, т.е. повторяют и закрепляют изученный материал. Вторая часть может быть заполнена после проведения эвристической беседы или создания проблемной ситуации, на основании знаний о строении атома и электронных оболочек.
Ниже приводится «закрытый» и один из вариантов «открытой» схемы-опоры по теме.
Тема. Периодический закон Д.И. Менделеева.
Периодический закон (по Д.И. Менделееву): Свойства простых тел, а также их соединений находятся в ________________________________________.
Периодическая система - графическое отображение периодического закона.
Период - это _____________________________________________________________________.
Группа - это ______________________________________________________________________.
Связь между периодической системой и строением атома.
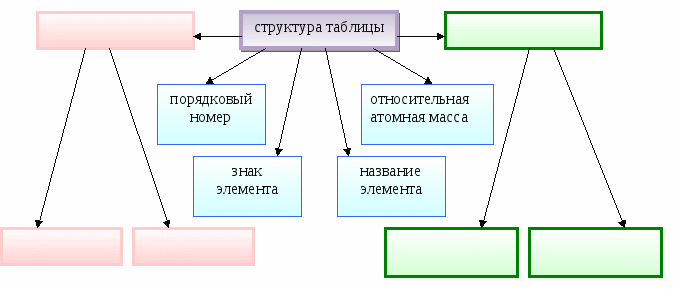
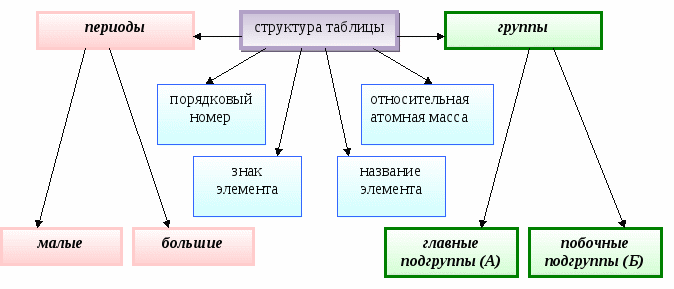
Структура таблицы
Характеристики атомного строения
Порядковый номер
Заряд ядра атома, количество протонов в ядре, общее количество электронов на всех электронных уровнях (оболочках)
Периодический закон (современная формулировка): Свойства элементов, а также их соединений находятся в __________________________________________________________.
Период - ______________________________________________. Расположен ____________.
Группа - ______________________________________________. Расположена _____________.
Металличность - __________________________________________________________________.
Неметалличность - ________________________________________________________________.
В периодах → (слева направо) - металлические свойства _________________, неметаллические
________________, т.к. с увеличением числа электронов на внешнем уровне ___________ радиус атома и способность отдавать электроны ____________, присоединять - ______________.
В группах (главных подгруппах) ↓ (сверху вниз) - металлические свойства _________________, неметаллические - _______________, т.к. с увеличением радиуса атома способность отдавать электроны _______________, а присоединять - ________________.
Тема. Периодический закон Д.И. Менделеева.
Периодическая система - графическое отображение периодического закона.
Периодический закон (по Д.И. Менделееву): Свойства простых тел, а также их соединений находятся в периодической зависимости от атомных весов элементов.
Период - это последовательность элементов, которая начинается щелочным металлом и заканчивается инертным газом.
Группа - это последовательность элементов, сходных по физическим и химическим свойствам.
Связь между периодической системой и строением атома.
Структура таблицы
Характеристики атомного строения
Порядковый номер
Заряд ядра атома, количество протонов в ядре, общее количество электронов на всех электронных уровнях (оболочках)
Период
Количество электронных оболочек, номер главного квантового числа,
размеры (радиус) атома
Группа
Количество электронов на внешней оболочке (для элементов главных подгрупп), количество валентных электронов
Относительная атомная
масса
Сумма масс всех протонов и нейтронов в определенном изотопе
Периодический закон (современная формулировка): Свойства элементов, а также их соединений находятся в периодической зависимости от заряда ядра атомов этих элементов.
Период - это последовательность элементов с одинаковым количеством электронных оболочек, причем, количество электронов на внешнем уровне увеличивается от одного до восьми (в главных подгруппах). Расположен → (слева направо).
Группа - это последовательность элементов, имеющих одинаковое строение внешней оболочки (для элементов главных подгрупп), но разное количество уровней. Расположена
↓ (сверху вниз).
Металличность - способность атома отдавать электроны во время химических реакций.
Неметалличность - способность атома присоединять электроны во время химических реакций.
В периодах → (слева направо) - металлические свойства уменьшаются, неметаллические увеличиваются, т.к. с увеличением числа электронов на внешнем уровне уменьшается радиус атома и способность отдавать электроны ослабевает, присоединять - усиливается.
В группах (главных подгруппах) ↓ (сверху вниз) - металлические свойства увеличиваются, а неметаллические - уменьшаются, т.к. с увеличением радиуса атома способность отдавать электроны усиливается, а присоединять - ослабевает.
Тема. Строение атома.
Содержание материала. История открытия строения атома, современные представления о строении атома и его основные (с точки зрения химии) элементарные частицы. Характеристики протона, электрона и нейтрона в истинных значениях и принятых в химии относительных значениях. Связь между массой и зарядом ядра по периодической системе с количеством электронов, протонов и нейтронов. Понятие «изотоп».
Технология работы с опорной схемой: заполняется на протяжении одного урока с использованием знаний по физике и комментариями учителя химии. В работе учащиеся используют периодическую систему.
Обучающие цели: показать межпредметную связь, сформировать понимание картины единства современного мира; научить делать выводы и выделять главное; продолжить формирование составления краткого конспекта, который базируется на логическом построении большого объема учебного материала; создать условия для повторения материала, если необходимо, за короткий промежуток времени.
Дидактические цели: ввести представление о современных взглядах на строение атома и историческое формирование этих знаний; сформировать знания об элементарных частицах атома, их расположении в атоме и роль в знаниях о веществе; ввести понятие «изотоп» и указать принципиальные отличия между изотопами; сформировать умение давать характеристику количества элементарных частиц в атоме на основе положения в таблице.
Результат. Учащиеся хорошо усваивают знания о строении атома и его элементарных частицах; понимают закономерности между зарядом атома, количеством электронов, протонов и нейтронов и массовым числом изотопа; быстро устанавливают взаимосвязь между строением атома и периодической системой Д.И. Менделеева, что в дальнейшем создает хорошую теоретическую базу для понимания строения вещества.
Ниже приводится «закрытый» и один из вариантов «открытой» опорной схемы по теме.
Тема. Строение атома.
Из истории открытий:
1895 г. - Рентген - явление рентгеновского излучения;
1897 г. - Пьер и Мария Кюри - явление радиоактивности;
1897 г. - Томпсон - открытие электрона - β-излучения;
1911 г. - Резерфорд - открытие α-излучения, первые представления о строении атома, планетарная модель;
1913 г. - Бор - квантовая теория строения атома, модель атома по Бору.
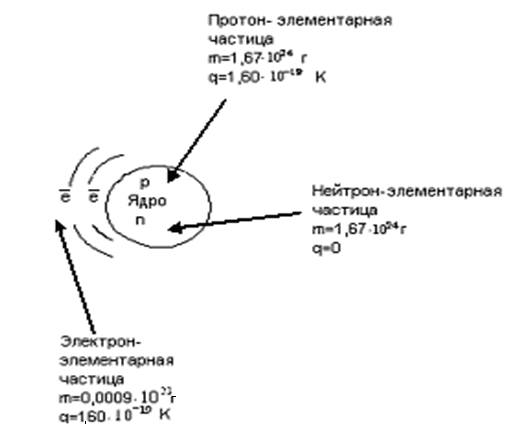
В химии приняты относительные характеристики масс и зарядов частиц:
-
Частица
Характеристика
e-
p
n
Масса (m), а.е.м.
0
1
1
Заряд (q)
-1
+1
0
Атом - _____________частица вещества (q атома = ___).
qe- + qp = 0, это значит, что N e- = N p
Количество ________ (e-) в атоме _______ количеству протонов ( p)
Заряд ядра, количество протонов, количество электронов показывает __________ __________
___________ в таблице Д.И. Менделеева.
М (атома) = М (ядра) = N p М p + N n М n (масса всех протонов + масса всех нейтронов атома)
N n = Аr - N p (по таблице Д.И. Менделеева)
Изотопы - разновидности _______ одного и того же элемента, имеющие одинаковый_______ _______, но разную___________ _________.
(Одинаковое количество _______ и _______ , но разное количество__________).
Аr любого элемента в таблице Д.И.Менделеева - это средняя масса всех его изотопов, существующих в природе.
Изотопы водорода: 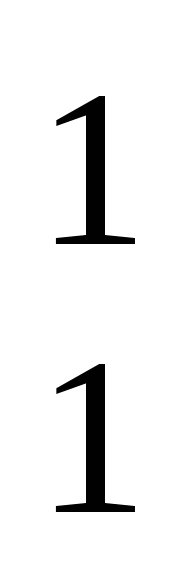 Н - протий,
Н - протий, 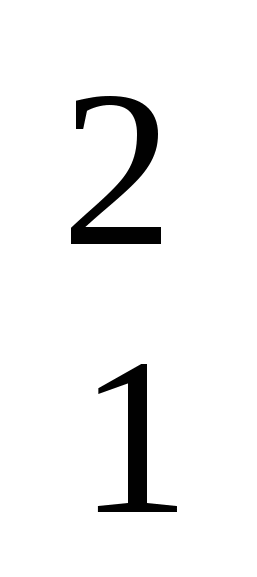 Н - дейтерий,
Н - дейтерий, 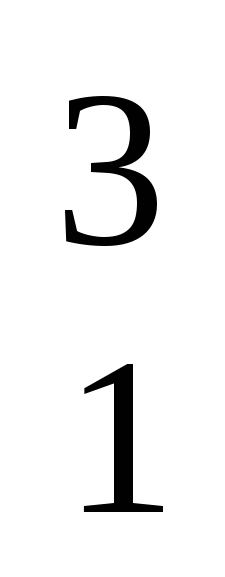 Н - тритий.
Н - тритий.
Изотопы кислорода: 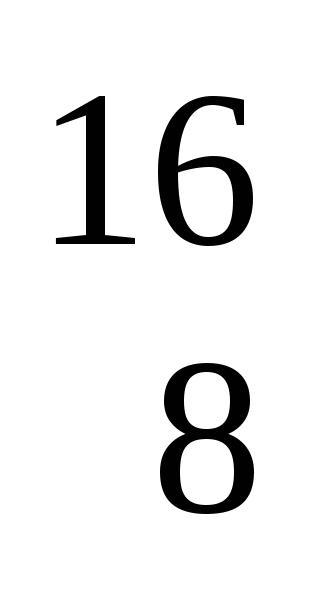 О
О  О
О  О
О
Количество e- 8 __ __
p 8 __ __
n 8 __ __
массовое число (относительная атомная масса изотопа)


 О
О
заряд ядра, количество протонов в ядре
Тема. Строение атома.
Из истории открытий:
1895 г. - Рентген - явление рентгеновского излучения;
1897 г. - Пьер и Мария Кюри - явление радиоактивности;
1897 г. - Томпсон - открытие электрона - β-излучения;
1911 г. - Резерфорд - открытие α-излучения, первые представления о строении атома, планетарная модель;
1913 г. - Бор - квантовая теория строения атома, модель атома по Бору.

В химии приняты относительные характеристики масс и зарядов частиц:
-
Частица
Характеристика
e-
p
n
Масса (m), а.е.м.
0
1
1
Заряд (q)
-1
+1
0
Атом - электронейтральная частица вещества (q атома = 0).
qe- + qp = 0, это значит, что N e- = N p
Количество электронов (e-) в атоме равно количеству протонов ( p)
Заряд ядра, количество протонов, количество электронов показывает порядковый номер элемента в таблице Д.И. Менделеева.
М (атома) = М (ядра) = N p М p + N n М n (масса всех протонов + масса всех нейтронов атома)
N n = Аr - N p (по таблице Д.И. Менделеева)
Изотопы - разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разную атомную массу.
(Одинаковое количество p и e-, но разное количество n).
Аr любого элемента в таблице Д.И.Менделеева - это средняя масса всех его изотопов, существующих в природе.
Изотопы водорода:  Н - протий,
Н - протий, 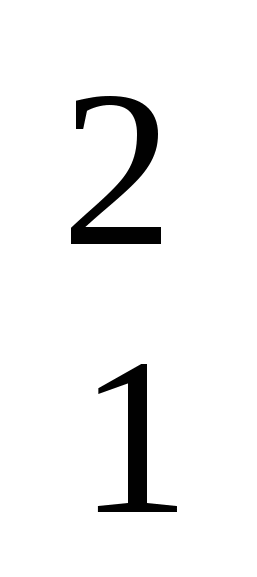 Н - дейтерий,
Н - дейтерий, 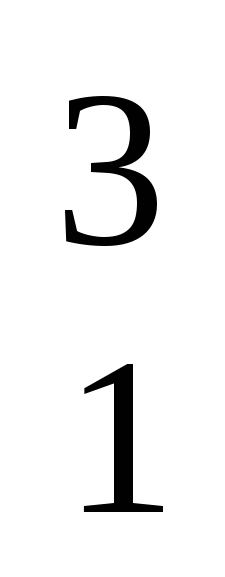 Н - тритий.
Н - тритий.
Изотопы кислорода: 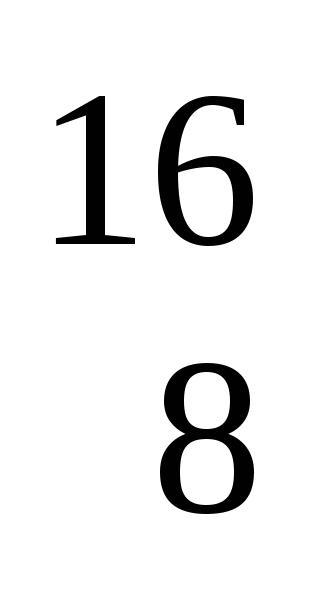 О
О 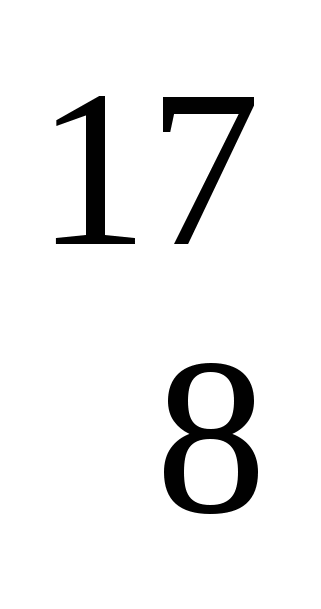 О
О  О
О
Количество e- 8 8 8
p 8 8 8
n 8 9 10
массовое число (относительная атомная масса изотопа)


 О
О
заряд ядра, количество протонов в ядре
Тема. Строение электронных оболочек атомов.
Содержание материала. Понятие «орбиталь», «электронный слой» или «энергетический уровень», «главное квантовое число», виды орбиталей; порядок заполнения электронных слоев, орбиталей в элементах I и II периодов периодической системы Д.И. Менделеева.
Технология работы с опорной схемой. Заполняется на протяжении одного или двух уроков с помощью учителя химии. Обязательно используется имеющаяся наглядность (таблицы или модели атомных орбиталей). Для работы с опорной схемой учащиеся используют периодическую систему.
Обучающие цели: показать связь между химией и физикой; продолжить формирование понимания целостной картины современного мира; научить делать выводы и выделять главное; продолжить формирование составления краткого конспекта, который базируется на логическом построении большого объема учебного материала; создать условия для повторения материала, если необходимо, за короткий промежуток времени.
Дидактические цели: ввести понятия «орбиталь и ее виды», «электронный слой», «энергетический уровень»; ввести представление о современных взглядах на строение атомных орбиталей; сформировать знания о видах движения электронов вокруг ядра атома; дать пояснения о порядке заполнения электронных слоев и орбиталей; сформировать умение записывать разными способами строение электронных орбиталей на основе положения элемента в таблице.
Результат. Учащиеся с помощью учителя усваивают общие закономерности заполнения электронных орбиталей и сначала с помощью учителя, а потом самостоятельно заполняют электронные слои элементов II периода. Формируется взаимосвязь между строением атомных орбиталей и таблицей, что в дальнейшем создает хорошую теоретическую базу для понимания строения вещества.
Рекомендации. Предлагаемую опорную схему лучше показать учащимся не в начале урока, а после того как учитель введет представление и покажет имеющуюся наглядность. Первую часть схемы учащиеся заполняют вместе с учителем, а вторую могут заполнить самостоятельно после введения общего принципа. Целесообразно большую часть записей, касающихся строения электронных орбиталей элементов II периода отразить на доске для коррекции со стороны учителя.
Ниже приводится «закрытый» и один из вариантов «открытой» опорной схемы по теме.
Тема. Строение электронных оболочек атомов.
Расположение электронов в атоме.
Атом состоит из _______ и электронной оболочки.
Электронная оболочка атома - это совокупность всех _________в данном_________.
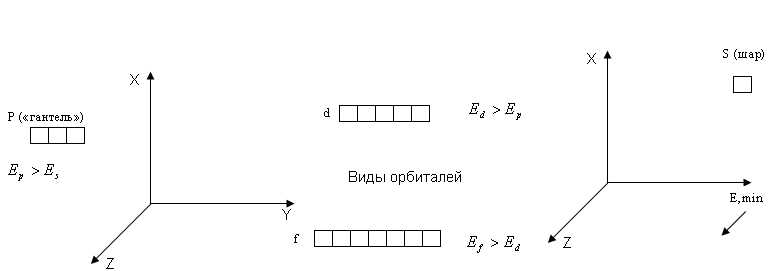
Атомная (электронная) орбиталь - это область пространства вокруг ______, где вероятность нахождения _______ наибольшая (равна ≈ 90%).
Электронное облако - это совокупность различных положений быстро движущегося _________.
Атомная орбиталь и облако электрона, который занимает эту орбиталь, имеют одинаковый размер, одинаковую форму и одинаковое направление в пространстве.
Энергетический уровень - совокупность_________, имеющих одинаковое значение главного квантового числа.
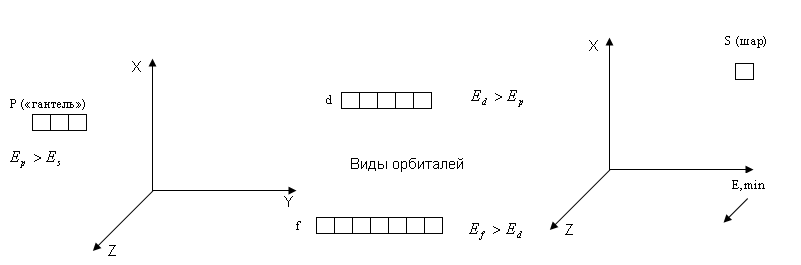
Максимальное количество электронов на одной орбитали - ____.
Спин - направление вращения__________ вокруг своей оси.
Неспаренный электрон - один________ на орбитали со спином в одном из вероятных направлений.
Спаренные электроны -______ ______на одной орбитали, имеющие___________________.
Порядок заполнения ____________: 1s 2s 2p 3s 3p 4s 3d
Правила заполнения орбиталей:
-
Первыми заполняются орбитали с меньшей энергией.
-
На одной и той же орбитали не могут находиться два электрона с одинаковыми спинами.
-
Если на слое имеются несколько орбиталей с одинаковой энергией, то сначала каждая заполняется неспаренным электроном, а затем происходит спаривание электронов.
№ периода
(главное
квантовое
число n)
Количество
электронных
слоев (уровней)
Количество
электронных
орбиталей
(n 2)
Виды
орбиталей
на слое (уровне)
Максимальное количество
Электронов
На слое (уровне)
( 2n 2)
1
1
1
s
2
2
2
4
s p
8
3
3
9
s p d
18
4
4
16
s p d f
32
Химические свойства элементов определяются строением электронных оболочек атомов.
Схемы строения атомов, их электронные и графические формулы:
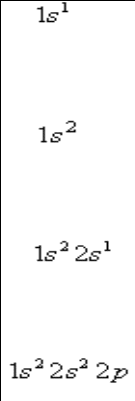

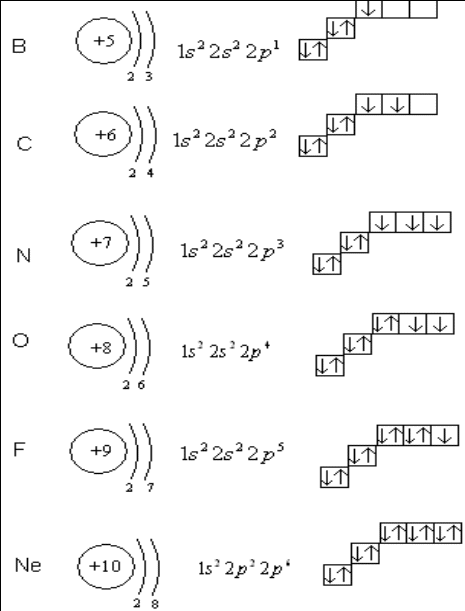
Тема. Строение электронных оболочек атомов.
Расположение электронов в атоме.
Атом состоит из ядра и электронной оболочки.
Электронная оболочка атома - это совокупность всех электронов в данном атоме.
Атомная (электронная) орбиталь - это область пространства вокруг ядра, где вероятность нахождения электрона наибольшая (равна ≈ 90%).
Электронное облако - это совокупность различных положений быстро движущегося электрона.
Атомная орбиталь и облако электрона, который занимает эту орбиталь, имеют одинаковый размер, одинаковую форму и одинаковое направление в пространстве.
Энергетический уровень - совокупность орбиталей, имеющих одинаковое значение главного квантового числа.
Максимальное количество электронов на одной орбитали - 2.
Спин - направление вращения электрона вокруг своей оси.
Неспаренный электрон - один электрон на орбитали со спином в одном из вероятных
направлений.
Спаренные электроны - два электрона на одной орбитали, имеющие разнонаправленные спины.
Порядок заполнения орбиталей: 1s 2s 2p 3s 3p 4s 3d
Правила заполнения орбиталей:
-
Первыми заполняются орбитали с меньшей энергией.
-
На одной и той же орбитали не могут находиться два электрона с одинаковыми спинами.
-
Если на слое имеются несколько орбиталей с одинаковой энергией, то сначала каждая заполняется неспаренным электроном, а затем происходит спаривание электронов.
№ периода
(главное
квантовое
число n)
Количество
электронных
слоев (уровней)
Количество
электронных
орбиталей
(n 2)
Виды
орбиталей
на слое (уровне)
Максимальное количество
Электронов
На слое (уровне)
( 2n 2)
1
1
1
s
2
2
2
4
s p
8
3
3
9
s p d
18
4
4
16
s p d f
32
Химические свойства элементов определяются строением электронных оболочек атомов.
Схемы строения атомов, их электронные и графические формулы:

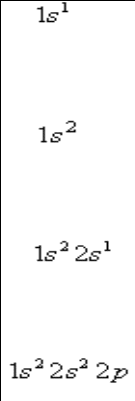

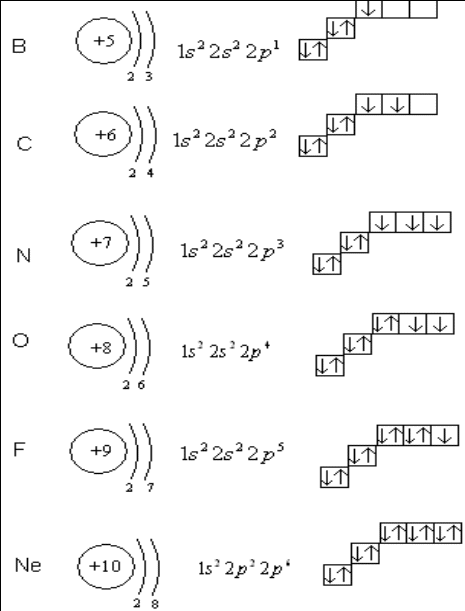
Тема. Растворы.
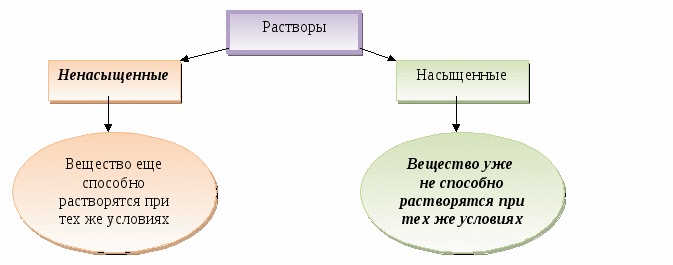
Содержание материала. Понятия «раствор», «растворимость»; виды растворов: насыщенные и ненасыщенные, концентрированные и разбавленные, их основные характеристики; зависимость процесса растворения от природы вещества и условий проведения процесса.
Технология работы с опорной схемой. Заполняется на одном уроке. Для работы со схемой используется учебник и дополнительная литература, для наглядности - таблица растворимости и кривые растворимости некоторых веществ (в твердом и газообразном состоянии).
Обучающие цели: повторить понятия «раствор» и «массовая доля вещества в растворе», ввести понятие «растворимость веществ»; проследить и проанализировать зависимость растворимости разных по природе веществ от условий растворения в воде; вывести понятия «насыщенный» и «ненасыщенный», «концентрированный» и «разбавленный раствор».
Результат. Вследствие работы с опорной схемой на уроке, повторении дома и перед следующим уроком учащиеся должны усвоить этот минимум обязательных знаний. Схема позволяет понять смысл слова «раствор» с физико-химической точки зрения, его виды и создает возможность решать качественные и количественные задачи.
Рекомендации. Учащиеся достаточно легко усваивают учебный материал, поэтому на этой теме можно разнообразить формы работы в классе, например, часть детей может работать индивидуально, часть - в группах сменного состава. Во время изучения этой темы можно ставить разнообразные проблемные вопросы и создавать проблемные ситуации, поскольку у учащихся уже имеются базовые знания и жизненный опыт.
Ниже приводится «закрытый» и один из вариантов «открытой» опорной схемы по теме.
Тема. Растворы. Растворение.
Раствор - __________ + вещество + ______________.
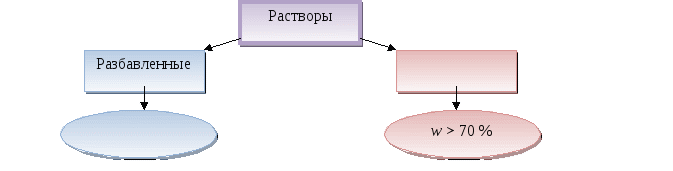
Растворимость - ________ вещества, способная _____________ в 1000мл растворителя (H2O) при данной температуре.
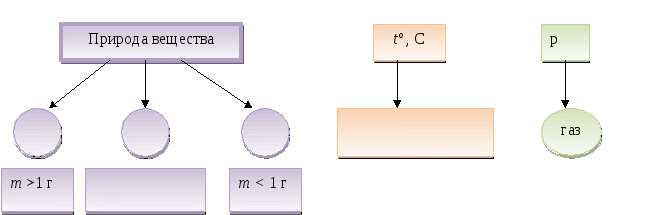
Факторы, влияющие на процесс растворения


Массовая доля вещества в растворе.
 =
=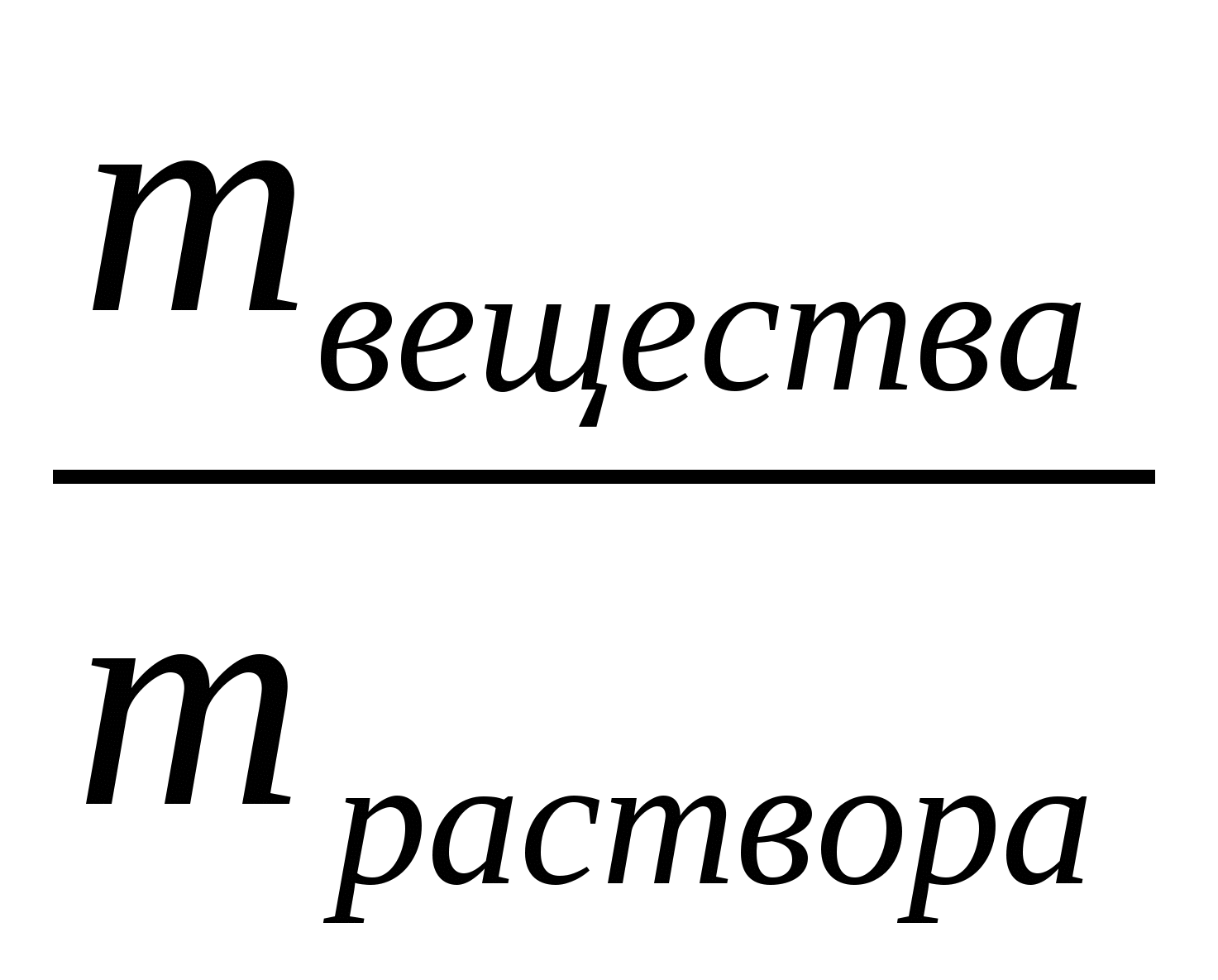 · 100% или w =
· 100% или w =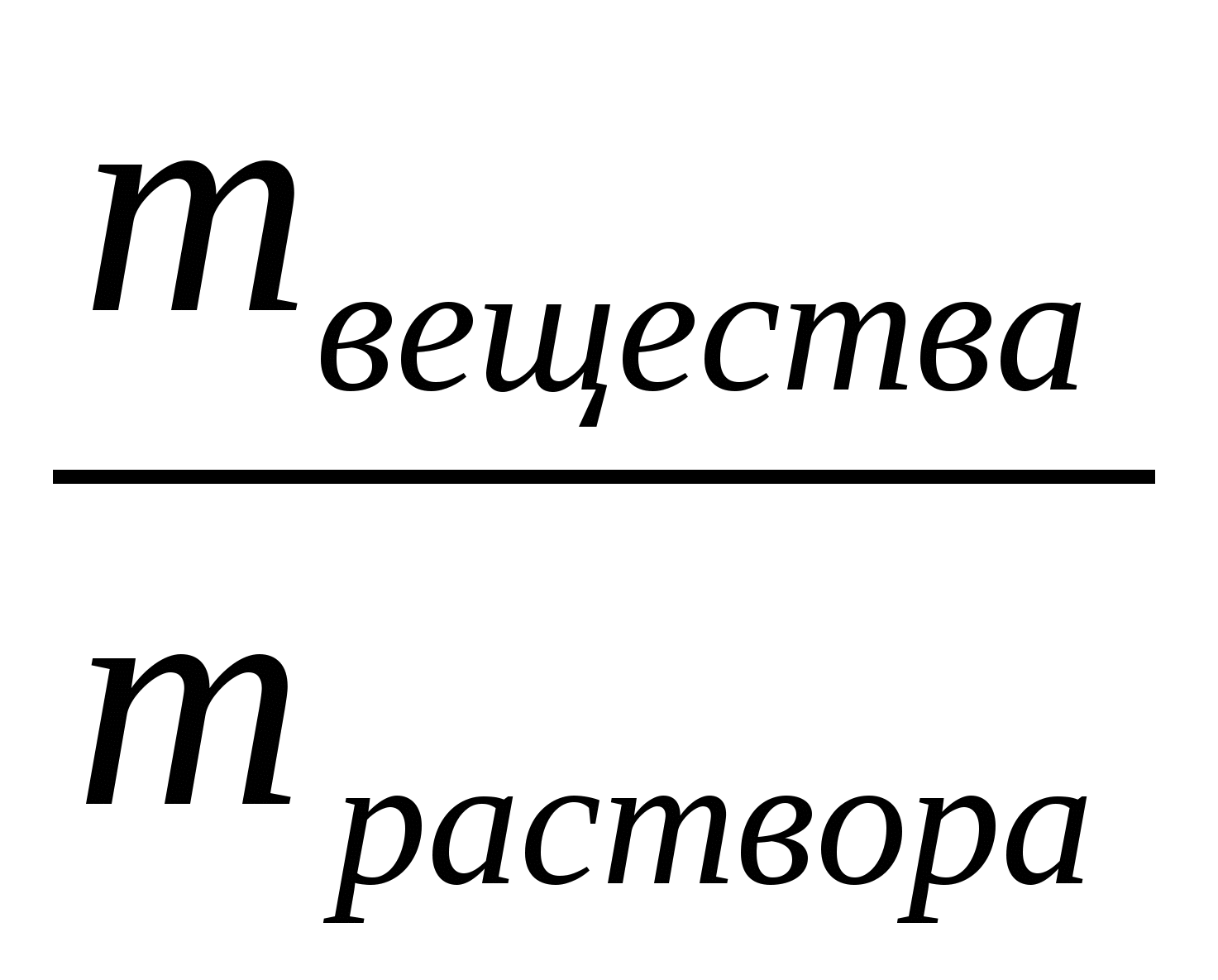

mраствора = + mводы
Тема. Растворы. Растворение.
Раствор - растворитель (H2O) + вещество + продукты их взаимодействия.
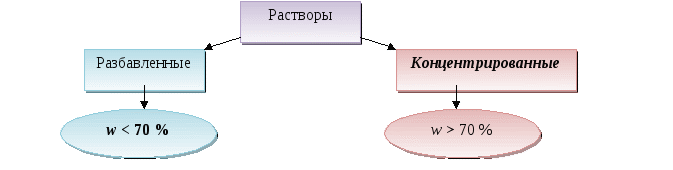
Растворимость - масса вещества, способная раствориться в 1000мл растворителя (H2O) при данной температуре.
Факторы, влияющие на процесс растворения


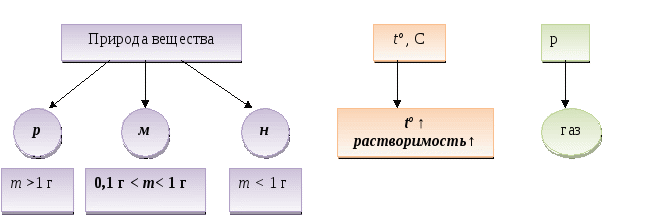
Массовая доля вещества в растворе.
w % =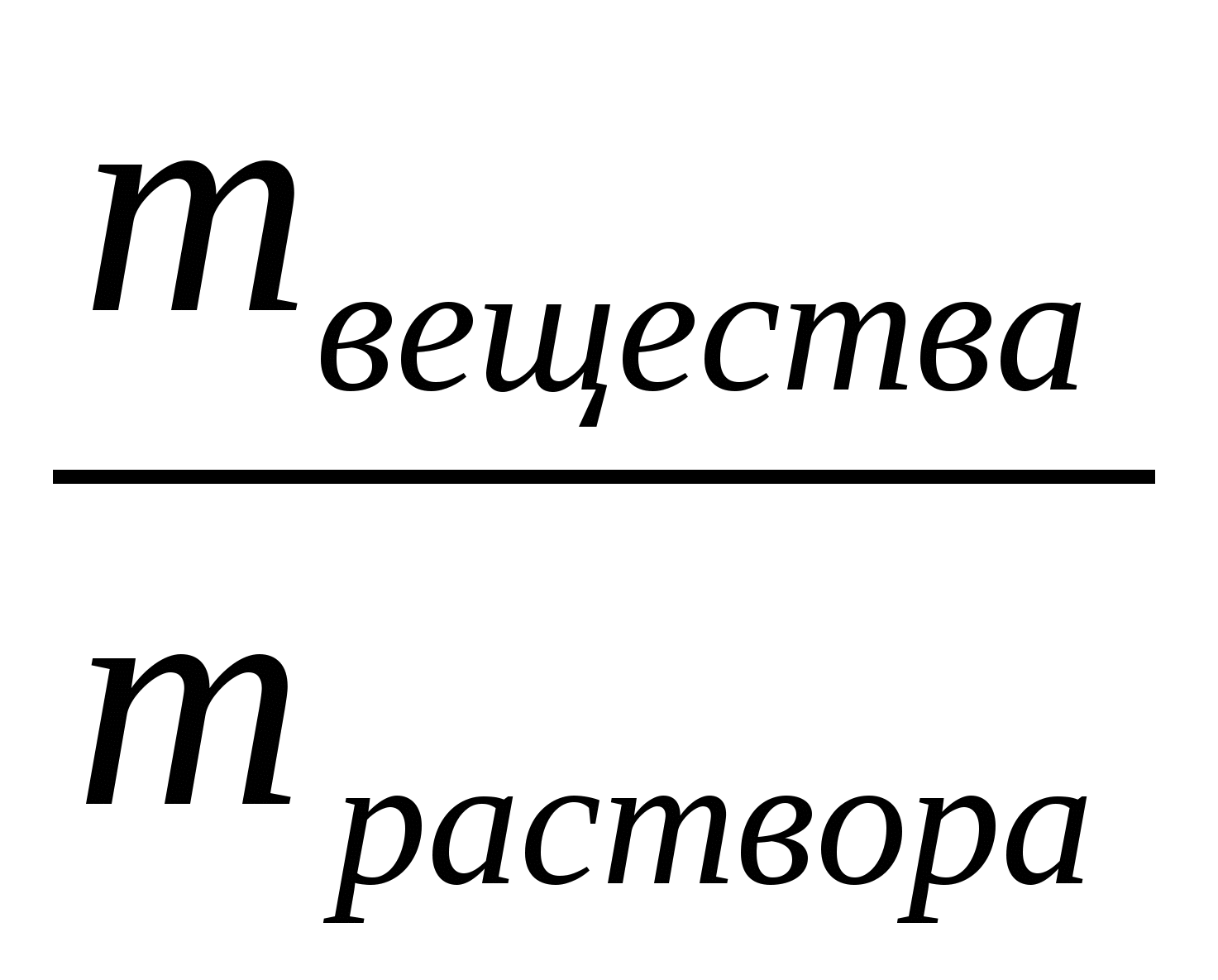 · 100% или w =
· 100% или w =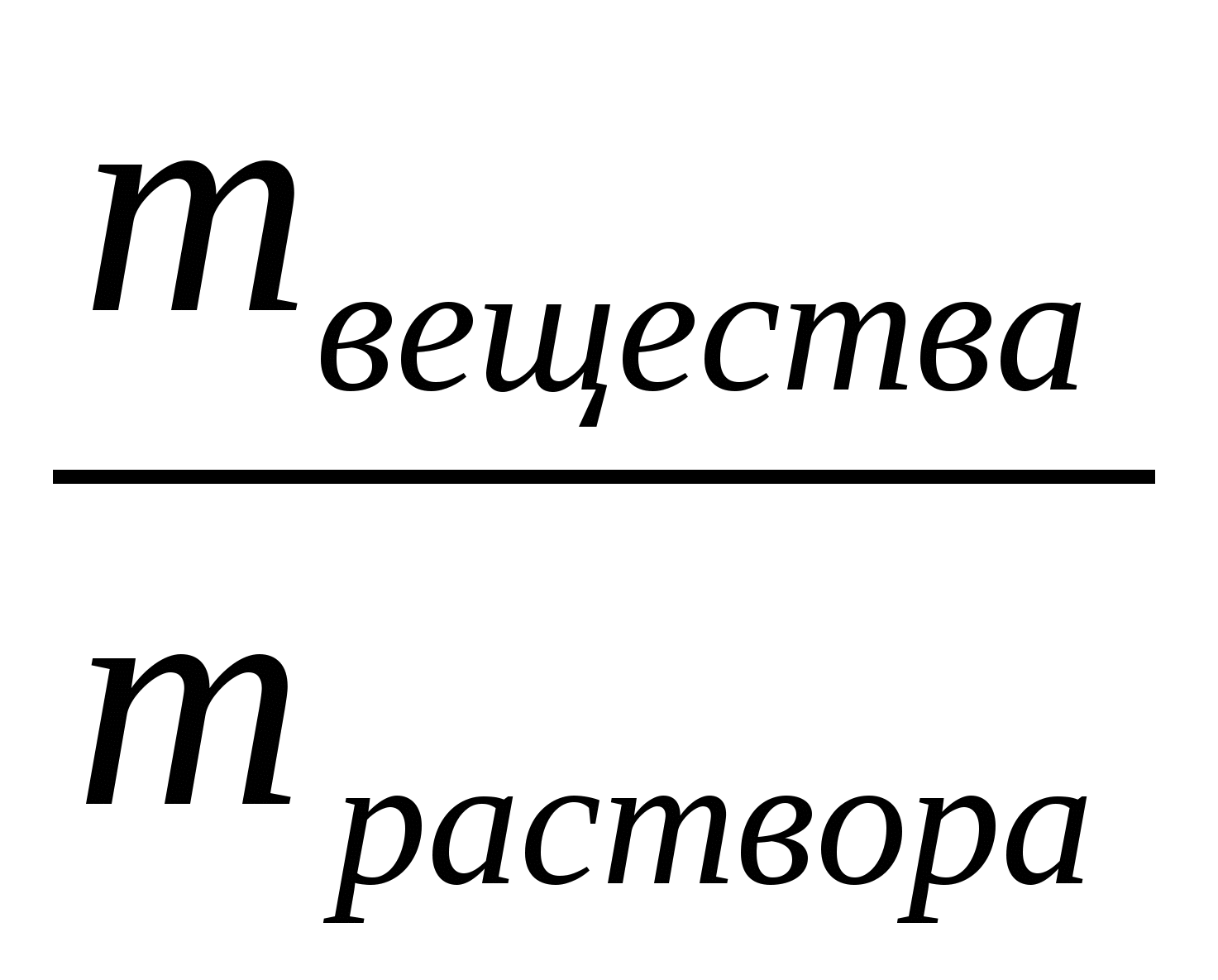
mраствора = mвещества+ mводы
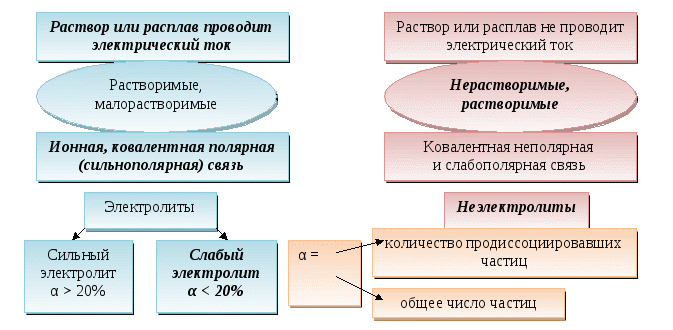
Тема. Электролитическая диссоциация.
Содержание материала. Электролиты, неэлектролиты, степень диссоциации, сильные и слабые электролиты. Механизм электролитической диссоциации веществ с ионной и ковалентной полярной связью. Диссоциация кислот, солей и оснований в воде. Катион, анион. Алгоритм написания уравнений диссоциации основных классов соединений в водных растворах.
Технология работы с опорной схемой. Заполняется на протяжении нескольких уроков, на рассмотрение учителя, в зависимости от распределения учебного материала на каждом уроке.
Обучающие цели: научить выделять главное и формулировать понятия и характеристики кратко, используя лишь ключевые слова; научить составлять краткий конспект, который базируется на логическом построении большого объема учебного материала; создать условия для повторения материала, по необходимости, за короткий промежуток времени.
Дидактические цели: дать представление о поведении веществ при растворении в воде; рассмотреть смысл понятий «гидратация» и «диссоциация» и энергетические характеристики этих процессов; ввести понятия «катион» и «анион», «гидратированный ион», «кристаллизационная вода», «кристаллогидраты»; рассмотреть диссоциацию основных классов неорганических веществ; дать общую схему написания уравнений реакций диссоциации.
Результат. Вследствие работы с опорной схемой на нескольких уроках, повторении дома и перед следующим уроком учащиеся должны усвоить минимум обязательных знаний. Эти знания позволят им выполнять упражнения по этой теме: выделять среди совокупности понятий главные (электролит и неэлектролит), записывать уравнения диссоциации электролитов, относящихся к классам кислот, оснований, солей.
Рекомендации. Лучше ввести все главные понятия на одном уроке, например, после демонстрации проблемных экспериментов. Механизм процесса лучше сначала рассмотреть на доске или по школьным таблицам или по схемам, предложенными в учебнике, и только после этого предложить учащимся понять и осмыслить то, что изображено на опорной схеме. Общие записи процессов диссоциации кислот, оснований и солей целесообразно рассматривать как алгоритм написания уравнений диссоциации. Во время отработки навыков работы по схеме используется таблица растворимости.
Ниже приводится «закрытый» и один из вариантов «открытой» опорной схемы по теме.
Тема. Теория электролитической диссоциации.
Чистые вещества

Растворение - физико-химический процесс.

______________ (диполь)
Гидратация - ______________________________________________________________________.
Е (гидратации) - ___________________________________________________________________.
Диссоциация - ____________________________________________________________________.
Е (диссоциации) - _________________________________________________________________.
Электролитическая диссоциация - ___________________________________________________.
Гидратная оболочка - ______________________________________________________________.
Гидратированный ион - ____________________________________________________________.
Кристаллогидраты - _______________________________________________________________
Вещества с ионной связью
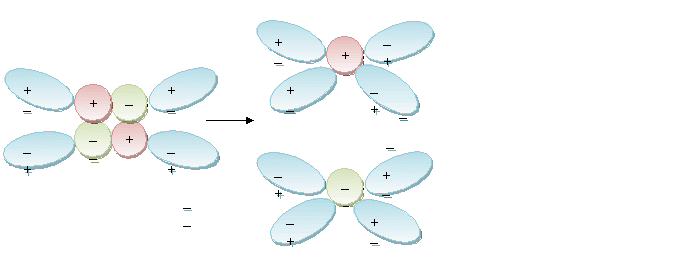
Вещества с ковалентной полярной связью
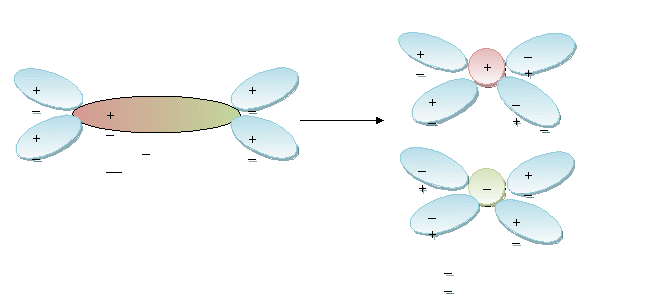
С
 ложные вещества диссоциируют: АВ А+ + В -
ложные вещества диссоциируют: АВ А+ + В -
А+ Катион - _________________________________________________________________
В - _______ - _______________________________________________________________
НnХ → nН+ + Х n-
НCl →
Me(OH) n → Men+ + nOH-
NaOH →
Men Хm→ nMem+ + mХn-
NaCl →
Оксиды - ________________________________ в водных растворах.
Качественный ион - ______________________________________________________________.
Ba2+ + _______ → BaSO4↓
Ag+ + _________→ AgCl↓
Cu2+ + ________ → Cu(OH)2↓
Тема. Теория электролитической диссоциации.
Чистые вещества

 Растворение - физико-химический процесс.
Растворение - физико-химический процесс.

Молекула воды (диполь)
Гидратация - процесс ориентации молекул воды вокруг ионов (молекул) кристаллической решетки.
Е (гидратации) - поглощается.
Диссоциация - процесс отрывания гидратированного иона от кристаллической решетки.
Е (диссоциации) - выделяется.
Электролитическая диссоциация -процесс распада электролита на ионы в растворе или в расплаве.
Гидратная оболочка - оболочка из молекул воды, расположенных вокруг иона.
Гидратированный ион - ион, окруженный диполями воды.
Кристаллогидраты - твердые вещества, в кристаллических решетках которых сохранилась гидратная оболочка, крепко связанная с ионами вещества (кристаллизационная вода).
Вещества с ионной связью

 Вещества с ковалентной полярной связью
Вещества с ковалентной полярной связью 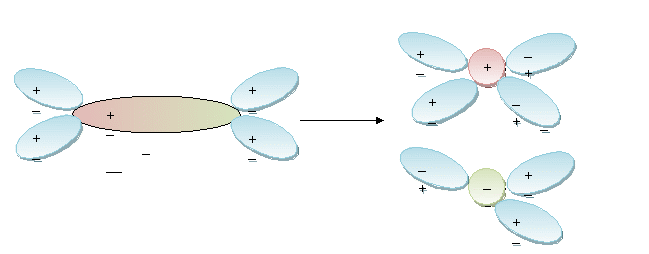
С
 ложные вещества диссоциируют: АВ А+ + В -
ложные вещества диссоциируют: АВ А+ + В -
А+ Катион, положительно заряженный ион
В - Анион, отрицательно заряженный ион
НnХ → nН+ + Х n-
НCl → Н+ + Cl-
Me(OH) n → Men+ + nOH-
NaOH → Na+ + OH-
Men Хm→ nMem+ + mХn-
NaCl → Na+ + Cl -
Оксиды - не диссоциируют в водных растворах.
Качественный ион - ион, с помощью которого можно определить наличие другого иона в растворе.
Ba2+ + SO42- → BaSO4↓
Ag+ + Cl-→ AgCl↓
Cu2+ + 2OH- → Cu(OH)2↓
41


