- Преподавателю
- Другое
- Исследование на тему Химия гидросферы
Исследование на тему Химия гидросферы
| Раздел | Другое |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Иванова Т.В. |
| Дата | 13.12.2015 |
| Формат | docx |
| Изображения | Есть |
CОДЕРЖАНИЕ
Введение
3
Глава 1. Глобальный гидрологический цикл и его структура
4
-
Определение понятий гидрологического цикла
4
-
Структура глобального гидрологического цикла
7
-
Океаническое звено
8
1.2.2 Континентальное звено
13
Глава 2. Химия континентальных вод, дельт рек и морской воды
23
2.1. Химия континентальных рек
23
2.1.1. Химия элементов
23
2.1.2. Химия воды и режимы выветривания
25
2.1.3. Кремний и алюминий
27
2.1.4. Биологические процессы
29
2.1.5. Питательные вещества и эвтрофикация
31
2.1.6. Загрязнение подземных вод
34
2.2. Процессы в дельтах
35
2.2.1. Агрегация коллоидного материала в дельтах
37
2.2.2. Процессы перемешивания в дельтах
38
2.2.3. Гальморолиз и ионный обмен в дельтах
39
2.2.4. Микробиологическая деятельность в дельтах
40
2.3. Химия главных ионов в морской воде
41
2.4. Химический круговорот главных ионов
44
2.4.1. Потоки море-воздух
44
2.4.2. Эвапориты
45
2.4.3. Катионный обмен
45
2.4.4. Осаждение карбонатов
46
2.4.5. Опаловые силикаты
51
2.4.6. Сульфиды
52
2.4.7. Баланс запасов главных ионов морской воды
53
2.4.8. Антропогенное воздействие на главные ионы
54
Заключение
56
Список использованных источников
58
ВВЕДЕНИЕ
Проблема охраны окружающей среды сложна и многопланова. Она включает как чисто научные, так и экономические, социальные, правовые и эстетические аспекты. В основе процессов, обусловливающих современное состояние биосферы, лежат физико-химические превращения веществ. Это направление рассматривает физические изменения и химические процессы в биосфере, пути миграции и трансформации химических соединений природного и антропогенного происхождения в атмосфере, гидросфере, литосфере, дает характеристику основных химических загрязнителей, способов определения уровня загрязнения, предлагает методы защиты и борьбы с загрязнением окружающей среды.
Временные пределы изучаемых химией окружающей среды процессов составляют от долей минуты до нескольких столетий.
В своей контрольной работе я рассмотрю понятия глобального гидрологического цикла, его структуру и строение гидросферы, химию континентальных вод, дельт рек и морской воды, основные загрязняющие вещества подземных вод, опишу химический круговорот главных ионов в гидросферных комплексах.
Глава 1. ГЛОБАЛЬНЫЙ ГИДРОЛОГИЧЕСКИЙ ЦИКЛ И ЕГО СТРУКТУРА
-
Определение понятий гидрологического цикла
Глобальный гидрологический цикл - это важнейшая составная часть общепланетарного обмена веществ и энергии, представляющая собой перемещение водных масс и их трансформацию в процессе круговорота воды на Земле [1].
Вода покрывает 70% поверхности Земли, но трудно представить себе общую сумму воды, так как мы можем увидеть только небольшую часть ее. Следующая диаграмма отображает объемы воды, содержащейся на Земле, в океанах и в атмосфере. Стрелки указывают на ежегодный обмен воды между ними [2].
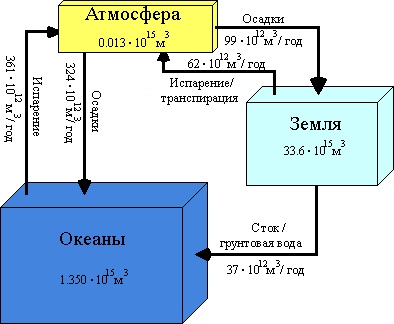
Рис.1. Диаграмма содержания и обмена воды на Земле, в океанах и атмосфере
Океаны содержат 9,.5% всей воды, земля 2,4% и атмосфера - менее чем 0,001%, что может показаться очень удивительным, поскольку вода играет очень важную роль в формировании погоды. Ежегодные осадки, выпадающие на землю, более чем в 30 раз превышают суммарное количество воды, способное удерживаться атмосферой. Этот факт указывает на быструю циркуляцию воды между поверхностью земли и атмосферой [2].
Водные массы - генетически и качественно единые объемы воды, образующиеся в определенных районах гидросферы и распространяющиеся из этих очагов своего формирования в процессе круговорота воды как единое целое. Таким образом, это - разнокачественные объемы природной воды из-за различного состава и концентрации в ней растворенных и взвешенных минеральных и органических веществ и водных организмов [1].
Итак, глобальный гидрологический цикл (ГГЦ), если так понимать термин «водные массы», - это гораздо более общее понятие, чем просто влагооборот или круговорот воды на Земле, поскольку ГГЦ включает и перенос с водой других веществ, организмов с заключенной в них энергией [1].
Поверхностные воды гидросферы - это совокупность взаимодействующих и трансформирующихся водных масс. А воздушные массы, из которых состоит атмосфера, рассматриваются в качестве газообразной модификации океанических и континентальных водных масс, по-разному претерпевших метаморфизм в процессе испарения воды в очагах формирования генетически и качественно различных воздушных масс. Они отличаются от водных масс многократно меньшей плотностью и большей подвижностью, иным соотношением в своем составе N2, 02, С02 и других газов, содержанием воды в виде пара, капель и ледяных кристаллов, минеральных и органических микрочастиц аэрозоля. Таким образом, и водные, и воздушные массы имеют генетически обусловленную вещественную структуру, т. е. индивидуальное для каждой массы соотношение составляющих ее веществ [1].
Закономерное размещение этих масс в гидросфере и атмосфере образует обычно весьма изменчивую пространственную структуру обеих геосфер подобно тому, как разнообразные по происхождению и составу почвы и породы - гораздо более стабильную структуру литосферы Земли. Части пространства, разделяющие в гидросфере водные массы (а в атмосфере воздушные массы), в которых происходит взаимодействие и смешение соседних водных (воздушных) масс, называют фронтальными зонами. Эти зоны характеризуются существенно большими пространственными градиентами физических и химических характеристик воды (воздуха) по сравнению с ядрами водных (воздушных) масс. Находящаяся внутри таких зон граница водных масс называется гидрологическим фронтом, воздушных масс - атмосферным фронтом. Наряду с водными массами фронтальные зоны представляют собой важные пространственные элементы гидрологической структуры разнообразных водных объектов гидросферы [1].
Термин «глобальный гидрологический цикл» введен основоположником отечественной гидрологии В. Г. Глушковым: «Явления гидрологического цикла представляют собой перемещение водных масс из одной комбинации в другую». Девятью возможными комбинациями им названы три физических состояния, в которых может находиться вода: в виде пара, в виде жидкости и в твердом виде (лед и снег) в трех средах: в атмосфере, на земной поверхности и в литосфере. «Перемещение воды из одной среды в другую, - писал Глушков, - происходит преимущественно под влиянием силы тяжести, перемена состояния - под влиянием теплоты. Возможность обращаться в легкий пар сводит на нет результаты работы силы тяжести, и вода снова поднимается на высоту, чтобы оттуда начать новый путь своего снижения. Таким образом, явления гидрологии в некоторой своей части представляют собой вечную борьбу двух сил - силы тяжести и теплоты: вода, являясь могучим конденсатором тепловой энергии, получаемой от солнца, расходует громадные количества ее или в форме отдачи теплоты, или в форме работы против силы тяжести» [1].
Водяной пар очень легкий по сравнению с воздухом. При температуре 00С плотность водяного пара примерно в 300 раз меньше, чем плотность сухого воздуха. При 20°С это различие меньше, но все равно остается очень большим, порядка 70 раз. Вода - превосходный аккумулятор тепловой энергии. Это еще одно из физических свойств воды связано с ее очень большой теплоемкостью. Теплоемкость воды более чем в 3000 раз превышает теплоемкость воздуха. Чтобы нагреть в Мировом океане на 10С слой воды толщиной 1 м, нужно затратить столько же теплоты, сколько ее требуется для нагревания слоя воздуха толщиной 3 км, т.е. практически почти всю массу воздуха в тропосфере. Но свойство поглотителя тепловой энергии у воды резко увеличивается в момент ее фазового превращения из твердого состояния в жидкое и еще больше (примерно в 7 раз) - при ее переходе в пар. Таковы основные тепловые свойства воды в ее трех агрегатных состояниях, имеющие определяющее значение в энергетике ГГЦ [1].
Используемый в определении ГГЦ термин «водная масса» как объем воды со специфическими физическими и химическими свойствами введен в 1929 г. австрийским метеорологом и океанологом А. Дефантом при исследовании смешения двух или трех разнокачественных водных масс. Так назвал он «однородный ограниченный или неограниченный водный объект, характеризующийся вполне определенными физико-химическими свойствами» по аналогии с «воздушными массами» - термином, возникшим несколькими годами ранее в норвежской синоптической метеорологии, ведущим теоретиком которой был в то время В. Бьеркнес. В современной океанологии, по А.Д.Добровольскому, «водной массой следует называть некоторый, сравнительно большой объем воды, формирующийся в определенном районе Мирового океана - очаге, источнике этой водной массы, обладающей в течение длительного времени почти постоянным и непрерывным распределением физических, химических и биологических характеристик, составляющих единый комплекс, и распространяющийся как одно, единое целое» [1].
Именно глобальный обмен водными массами имел в виду С. Д. Муравейский, предложивший в 1934 г. понятие «мировой сток»: «...- это сложный процесс, определяющий взаимоотношения между океаном и водами суши, процесс обмена водных масс океана и суши, процесс исторический, в котором факторы геологические, географические, физические, химические, биологические не только определяют сам обмен и его характер, но и обусловливают круговорот веществ во всем процессе стока и в каждом водоеме (водном объекте) в частности. Следовательно, каждый водоем со своей качественной специфичностью представляет собой одну из фаз (частей) этого процесса стока, следовательно, и круговорот веществ в данном водоеме является в основном функцией круговорота веществ в результате процесса стока в целом» [1].
1.2. Структура глобального гидрологического цикла
Двухзвенная структура глобального гидрологического цикла, состоящая из океанического и континентального звеньев, взаимосвязанных атмосферным переносом воздушных масс и стоком с суши водных масс, существует на Земле давно, во всяком случае, на протяжении всего голоцена, т.е. последние 10-12 тыс. лет, прошедших с конца последнего материкового оледенения в северном полушарии [1].
В эту современную геологическую эпоху объем воды на нашей планете остается практически неизменным и составляет 1,39 млрд. км3. Главной причиной этого, как показали начатые в 60-е годы 20 века исследования химического состава мезосферы, служит процесс фотораспада водяного пара под воздействием жесткого (в интервале длин волн 0,143-0,186 мкм) ультрафиолетового солнечного излучения. Интенсивность этого процесса составляет около 4 • 1012 г Н2О/год и достигает максимального значения на высоте 70 - 80 км над уровнем моря. От 10 до 30 % водорода, образующегося при фотолизе Н2О, уходит из атмосферы Земли в космическое пространство [1].
Тяжелые по сравнению с водородом молекулы хемогенного кислорода, образующегося из воды в мезосфере, формируют самый верхний слой полного поглощения наиболее жесткой части ультрафиолетового излучения, губительной для живых организмов и воды (из-за ее фотолиза). Таким образом, экологическая значимость воды в том, что она является не только наибольшей по массе составной частью живых организмов, но и обеспечивает условия существования гидросферы и биосферы на Земле за счет ежегодного распада крайне малой доли своего объема (4 млн. м3 воды - это всего одна трехсотмиллиардная часть объема гидросферы). Второй защитный для человека озонный слой расположен в стратосфере в среднем на 60 км ниже, и поглощает умеренно жесткое излучение Солнца в интервале длин волн 0,22-0,29 и 0,31- 0,36 мкм [1].
1.2.1. Океаническое звено
Зарождается глобальный гидрологический цикл в Мировом океане, площадь которого составляет 70,8 % поверхности Земли. С его акватории испаряется в среднем 87,5 % объема воды, участвующей ежегодно в глобальном круговороте. Эта осредненная за многолетний период величина испарения составляет 505 тыс. км3/год. Большая ее часть - 405 тыс. км3/год воды - возвращается в Мировой океан в виде атмосферных осадков океанического происхождения, а 100 тыс. км3/год выносится океаническими воздушными массами на сушу (рис. 2.). Замыкается океаническое звено и весь ГГЦ в целом сложной системой течений, которыми ежегодно переносится 21,7 млн. км3 воды, т.е средняя величина их расхода оценивается примерно в 700 Св (1 Свердруп = 1 млн. м3/с) [1].
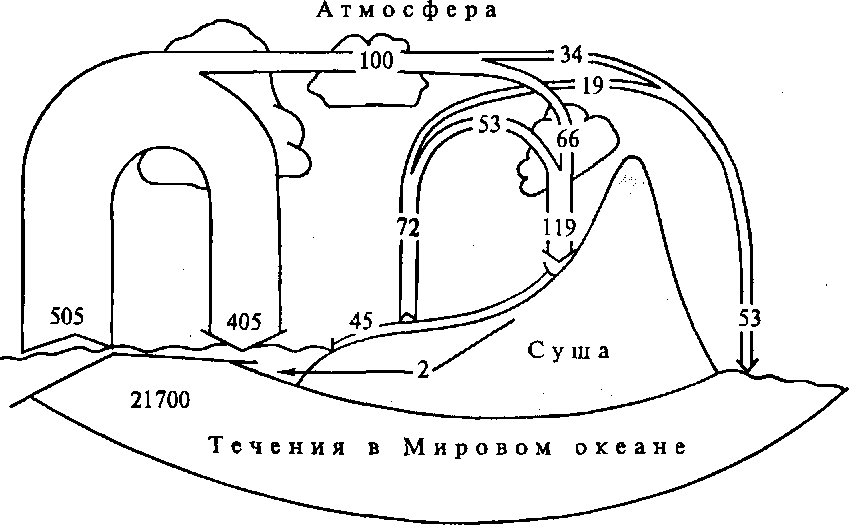 Рис. 2. Схема трансформации расхода воды (тыс. км3/год) в океаническом и континентальном звеньях глобального гидрологического цикла]
Рис. 2. Схема трансформации расхода воды (тыс. км3/год) в океаническом и континентальном звеньях глобального гидрологического цикла]
Мировой океан. В океане сосредоточено 96,4 % объема всех вод Земли, он обладает устойчивой гидрологической структурой. В нем существует четыре типа океанических водных масс (ВМ), составляющих четыре слоя переменной толщины. Самый верхний слой образуют приповерхностные ВМ (тропосферные) арктические, субарктические, субтропические, экваториальные, субантарктические и антарктические. Толщина этого слоя от 100 м в экваториальной и субполярных областях океанов до 500 - 900 м в областях субтропических антициклонических круговоротов океанических вод. Промежуточные ВМ образуют своеобразную границу между тропосферой и стратосферой океана во втором слое, расположенном на глубине от 600 - 800 до 1200 м. Водные массы этого типа характеризуются экстремальными значениями температуры и солености вследствие погружения холодных и менее соленых субарктических, субантарктических и антарктических ВМ либо вследствие интрузии в океанскую толщу более теплых и соленых морских ВМ из Средиземного, Красного, Аравийского, Тиморского морей, а также теплой атлантической ВМ в толщу Северного Ледовитого океана. Расположенные под слоем промежуточных ВМ стратосферные воды представлены двумя видами - водными массами с большей соленостью, образующимися в высоких широтах северного полушария, и водными массами Южного океана. Они перемещаются в сторону низких широт навстречу друг другу и там, где они соприкасаются, северные ВМ становятся глубинными (третий слой), а южные ВМ - придонными (четвертый слой океанической толщи вод) [1].
Мировому океану свойственна квазистационарная циркуляция вод, в своих общих чертах сохраняющаяся из года в год вследствие динамического взаимодействия океана и атмосферы. Схематично она представляет следующую картину. Во внутритропической зоне океана пассаты формируют направленное на запад дрейфовое течение, разветвляющееся в области нагона на две антициклонические циркуляции в субтропических зонах южного и северного полушарий. Центры этих циркуляций представляют собой очаги формирования тропосферных субтропических ВМ, достигающих среди приповерхностных водных масс наибольшей толщины из-за нисходящего здесь движения воды (даунвеллинг). Имеется такое же явление и на западном краю океанов, из-за чего там формируются экваториальные подповерхностные противотечения. А в области сгона у восточных побережий океанов происходит подъем глубинных вод (апвеллинг) [1].
Внутри антициклонических циркуляции формируются обширные водные массы, называемые водными массами I рода. Для тропической зоны океана наиболее типичны водные массы II рода, характеризующиеся постепенным увеличением солености и других свойств вследствие повышенного здесь испарения и малого количества осадков, а также различных внутримассовых процессов трансформации состава воды. Такая внутримассовая трансформация воды усиливается, когда водная масса перемещается из одной климатической зоны в другую. И особенно сильна эта трансформация в умеренных широтах из-за наибольшей здесь сезонной и синоптической изменчивости погодных условий. Кроме внутримассовой трансформации существует еще и фронтальная трансформация воды вследствие смешения двух и более соседних водных масс. При такой трансформации водная масса нередко резко изменяет свои свойства, поскольку смесь разнокачественных водных масс обладает специфическими свойствами. Например, смесь водных масс разной температуры или разной солености имеет плотность больше, чем плотность воды в ядре любой из участвующих в смешении водных масс. Фронтальная трансформация редко наблюдается в чистом виде, потому что процессы фронтального взаимодействия водных масс и воздействие на них атмосферы протекают одновременно, т.е. фронтальная трансформация обычно сочетается с внутримассовой трансформацией воды [1].
Таким образом, интенсивный внутри- и межокеанский обмен водными массами, сопровождающийся их фронтальной и внутримассовой трансформацией, служит главной причиной сравнительно малых различий химического состава океанических водных масс. Наибольшее значение солености воды - в ядре приповерхностной тропической североатлантической ВМ, наименьшее - в промежуточной антарктической ВМ в Атлантике. Большая стабильность вещественной и пространственной структуры океаносферы объясняется крайне медленным ее внешним водообменном [1].
Атмосферный этап. В процессе испарения воды на границе «океан-атмосфера» происходит коренная метаморфизация океанических водных масс. Существует два вида испарения воды с поверхности водоемов: физическое и механическое [1].
При физическом испарении молекулы воды, обладающие наибольшей скоростью движения, преодолевая силу поверхностного натяжения, внедряются в приграничный слой атмосферы, а затем поднимаются во все более высокие ее слои со скоростью, зависящей от плотностной стратификации и турбулентности воздуха над водоемом. Этот механизм способствует возникновению холодной поверхностной пленки толщиной 0,2 - 0,5 мм, в которой температура понижается к границе раздела вода - воздух на 0,5 - 0,6 °С и более. Одновременно в воде происходит концентрирование растворенных и взвешенных веществ, из-за которого их содержание в поверхностном микрослое (ПМС) может повышаться на 5-10 % по сравнению с концентрацией тех же веществ под ним в водной массе. Вместе с физическим испарением воды происходит и физическое испарение растворенных в ПМС ионов, которые в приводном слое воздуха образуют газообразные ассоциаты двух типов - гидратированные ионы и гидратированные молекулы солей, т.е. в оболочке из молекул воды[1].
При механическом испарении важную роль играет флотация. Всплывающие из водной толщи микропузырьки газов с сорбированными на их поверхности минеральными и органическими взвешенными веществами прорывают поверхностную пленку, и образующиеся при разрушении пузырьков микрокапли ПМС поднимаются на 2-3 см над водной поверхностью и увлекаются насыщаемым ими воздушным потоком. Таким образом, природная флотация водных масс не только увеличивает скорость образования водяного пара, но и приводит к возникновению аэрозольных частиц несколько большего размера [1].
Оба вида испарения интенсифицируются в штормовую погоду, когда увеличивающаяся турбулентность ветрового потока снижает насыщенность паром и аэрозолем приводного слоя воздуха. Кроме того, обрушение ветровых крупных волн резко увеличивает концентрацию и скорость движения воздушных пузырьков в верхнем 2-3-метровом слое водоема, что усиливает флотацию и пенообразование, а ветер срывает с гребней волн пену, испаряющуюся затем в воздушном потоке [1].
В результате этих процессов в состав океанических воздушных масс с поверхности Мирового океана поступает примерно 1,8-1,9 млрд. т/год морских солей, преимущественно NaCl. Крупные аэрозоли с радиусом r > 20 мкм, составляющие около 21 % массы океанического аэрозоля (рис. 3), распространяются в приземном слое воздуха, остальные увлекаются воздушными потоками в вышележащие слои атмосферы [1].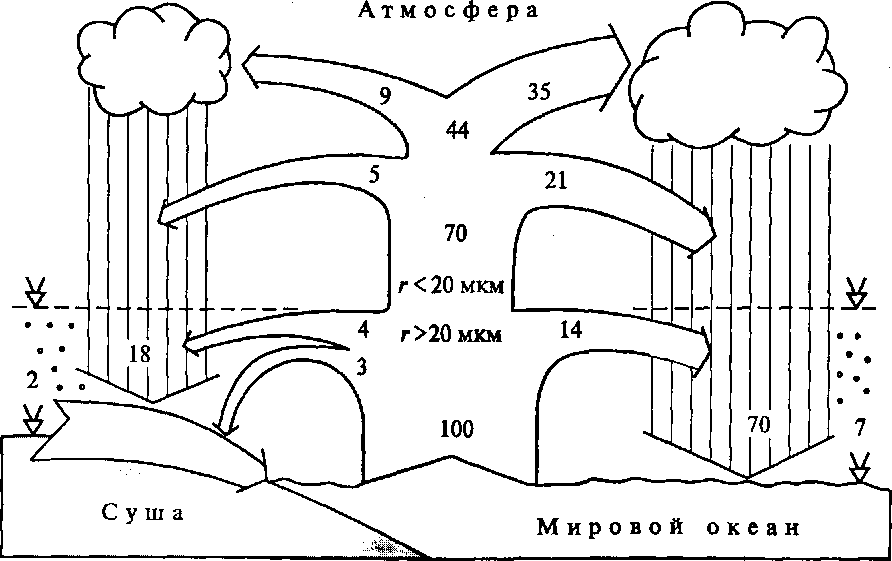 Рис. 3. Структура круговорота морских солей (в % ежегодно образующейся массы океанического аэрозоля, равной в среднем 1,8-1,9 млрд т/год, в глобальном гидрологическом цикле (r - средний радиус аэрозолей)
Рис. 3. Структура круговорота морских солей (в % ежегодно образующейся массы океанического аэрозоля, равной в среднем 1,8-1,9 млрд т/год, в глобальном гидрологическом цикле (r - средний радиус аэрозолей)
На рис. 3 видно, что 70 % массы морских солей оборачивается в океаническом звене ГГЦ, а 23 % возвращается в океан стоком с суши. При этом 44 % общей массы аэрозольных частиц морского генезиса участвует (в качестве ядер конденсации водяного пара) в формировании облачных систем и осадков из них, которые при выпадении вымывают еще столько же аэрозоля из подоблачного слоя воздуха над поверхностью как океана, так и суши. Это - так называемое влажное осаждение аэрозоля. Помимо ГГЦ, 12 % массы морских солей выпадает на земную поверхность в виде пыли (сухое осаждение), из них 3 % на океанское побережье и 2 % на остальную сушу, а 7% - на океан. Средняя минерализация осадков, поступающих из океанических воздушных масс на поверхность океанов, несколько более 6 мг/л: около 3 мг/л приходится на долю ионов С1 и Na, к которым добавляются преимущественно сульфатные ионы - продукт самоочищения атмосферы от ее загрязнения сернистым газом природного и антропогенного происхождения[1].
Средний слой испаряющейся воды с Мирового океана за многолетний период равен 1400 мм/год, в полярных широтах он составляет 100 - 400 мм/год, в экваториальных - до 2000 мм/год над теплыми течениями и 1000-1200 мм/год - над холодными.
Пространственная неоднородность испарения вызывает различную влагонасыщенность океанических воздушных масс. Среднегодовое влагосодержание воздуха в его слое 0-7 км над земной поверхностью равно 25 мм слоя воды (если сконденсировать весь водяной пар, находящийся в этом слое атмосферы) [1].
Перемещение воздушных масс над океанами и термодинамические условия формирования осадков в том или ином их районе определяют пространственно-временную неоднородность их выпадения на океаническую поверхность. Средняя многолетняя величина слоя осадков, поступающих на акваторию Мирового океана, равна 1270 мм/год (почти на 10 % меньше среднегодового слоя испарения). В тропических зонах у восточных берегов океанов над холодными течениями из-за устойчивой термической стратификации нижних слоев тропосферы осадков выпадает менее 100 мм/год. А в центральных и западных частях экваториальной зоны над теплыми течениями, где особенно благоприятны условия для развития мощной конвекции в тропосфере, слой осадков достигает 3200 мм/год и более. Превышение слоя осадков над слоем испарения несколько увеличивает здесь расход главных циркуляционных систем океанических течений [1].
Из поступающих на сушу с Мирового океана воздушных масс, средняя влажность которых 80%, 2/3 водяных паров, конденсируясь, выпадает на поверхность суши в виде адвективных атмосферных осадков. Остальная часть влаги (34 км3/год) проносится транзитом над сушей, формируя вместе с 30 % испарившейся с ее территории воды атмосферный сток с суши [1].
Средняя за многолетний период суммарная величина атмосферных осадков на поверхность Земли равна 577 тыс. км3/год, а среднее влагосодержание атмосферы - 12,9 тыс. км3 (или 25 мм), следовательно, средняя продолжительность пребывания воды в атмосфере
Та = 12,9 тыс. км3/577 (тыс. км3/год) = 0,022 года, (1)
или 8 суток, а смена ее в атмосфере происходит в среднем 45 раз за год. При этом на осадки ежедневно расходуется из атмосферы в среднем 12 % находящейся в ней влаги. Средняя скорость переноса влаги в нижнем семикилометровом слое атмосферы около 3 м/с (220 км/сут).
Таким образом, рассмотренные современные представления о разнообразных процессах массообмена на границе «океан - атмосфера» достаточно убедительно иллюстрирует выдвинутую полвека назад идею об обмене между Мировым океаном и сушей не просто водой, а именно водными массами, имеющими в тропосфере газообразный вид влагонасыщенных воздушных масс, содержащих водяной пар, облачные системы и аэрозоли морского и континентального происхождения [1].
1.2.2. Континентальное звено
Начало второму (континентальному) звену ГГЦ дают атмосферные осадки, выпадающие из воздушных масс океанического происхождения на сушу. Среднее их количество за многолетний период составляет 66 тыс. км3/год (рис.2). С океаническими воздушными массами поступает одновременно 0,4 млрд. т/год морских солей, что составляет 23% ежегодно образующейся на акватории Мирового океана массы аэрозоля. Наибольшая их часть (18%) выпадает с осадками из облачных систем и вымывается из подоблачного слоя, а остальная их часть (5%) оседает в виде пыли в периоды отсутствия осадков на побережье (3%) и в более удаленных от него районах (2%, рис. 3) [1].
Когда атмосферные осадки соприкасаются с земной поверхностью, сразу же происходит метаморфизация их химического состава под влиянием преимущественно двух природных процессов:
• концентрирования растворенных в воде веществ вследствие ее испарения;
• сильного изменения состава воды в результате эрозии и растворения веществ на поверхности и в толще почв и грунтов, а также при взаимодействии с растительным покровом и континентальными водными массами [1].
Эти процессы практически совершенно отсутствуют на территориях, покрытых ледниковым и снежным покровом (16,3 млн .км2 и 72 млн. км2, или 11 и 14 % суши соответственно). Здесь происходит круглогодичная или только сезонная аккумуляция атмосферных осадков. Процессы метаморфизации природных вод сильно ослаблены на территориях, покрытых многолетнемерзлыми грунтами (32-35 млн. км2, или 22 -24% суши). Период возобновления запаса воды в полярных ледниках и подземных льдах зоны многолетней мерзлоты - около 10 тыс. лет, а в горных ледниках - в среднем 1600 лет [1].
Общее количество испаряющейся воды с поверхности снега и льда, почвенно-растительного покрова, с акватории континентальных водных объектов и в процессах транспирации воды растительным покровом и хозяйственного использования водных ресурсов составляет в среднем за многолетний период 72 тыс. км3/год (рис.2). Вместе с транспирацией происходит и сравнительно небольшое, но очень экологически важное поглощение воды растениями в процессе фотосинтеза органического вещества. Расход воды на фотосинтез составляет 225 км3/год. Поскольку содержание воды в живом веществе принимается равным 80% биомассы, общий запас воды в биоте Земли - порядка 1 тыс. км3. Однако только 60 % этого объема биологически связанной воды активно участвует в ГГЦ. Среднее время возобновления биологической воды в организмах составляет несколько часов [1].
Испарившаяся с суши вода увеличивает влагонасыщенность воздушных масс над ее поверхностью и тем самым стимулирует выпадение из них осадков смешанного происхождения. Для этого необходимо, чтобы относительная влажность воздуха превысила 40 %. Благодаря вовлечению в осадкообразование местной влаги, общее количество атмосферных осадков, поступающих на сушу, на 80 % больше их океанической составляющей и равно в среднем 119 тыс. км3/год. Лишь 30% испарившейся на суше влаги (19 тыс. км3/год) включается в атмосферный сток (рис. 2) [1].
Одновременно над сушей происходит сильная трансформация состава воздушных масс вследствие поступления в них континентального аэрозоля. Большую часть его фракций, растворимых водой, составляют сульфаты, образующиеся в атмосфере из сероводорода и сернистого газа вулканического происхождения, продуктов разложения и горения органических веществ при пожарах, сжигании топлива, мусора. К ним добавляются соли почвенного покрова, выдуваемые ветром, Около 2,8 млрд. т/год этих веществ континентального происхождения участвует в формировании фронтальных облачных систем, 30% их массы выносится в составе воздушных масс с суши в Мировой океан, а остальные выпадают на сушу с атмосферными осадками. Поэтому средняя минерализация воды в осадках на сушу в 3 раза выше, чем в центральных районах океанов, и составляет 18 -20 мг/л, причем доля в них хлоридов меньше, чем в осадках чисто океанического происхождения[1].
В полярных широтах и высокогорных районах минерализацию атмосферных осадков определяет состав облачной воды. В тропических широтах и промышленных регионах умеренных широт с загрязненным подоблачным слоем воздуха минерализация осадков в континентальном звене ГГЦ существенно выше и гораздо изменчивее во времени и пространстве. Атмосферные осадки в виде снега более эффективно очищают воздух от загрязняющих веществ благодаря меньшей скорости падения снежинок и их большей, относительно массы, поверхности по сравнению с дождевыми каплями. Поэтому минерализация осадков, накапливающихся в снежном покрове в холодную часть года, обычно больше, чем дождевых вод. В среднем на поверхность суши с осадками поступает 2,4 млрд. т/год минеральных солей [1].
Неиспарившаяся в континентальном звене вода инфильтруется в почвы и грунты и стекает по их поверхности в областях внешнего и внутреннего стока. Первые имеют общую площадь 119 млн. км2 (80% суши) и представляют собой водосборы океанов. Средний за многолетний период сток с них воды в Мировой океан равен 47 тыс. км3/год. Он состоит из речного стока (42 тыс. км3/год), стока льда преимущественно в виде откалывающихся и тающих в океанах айсбергов (3 тыс. км3/год ультрапресной воды) и подземного стока воды в виде субмаринных источников в прибрежной полосе океанического побережья (2 тыс. км3/год). Суммарный ионный сток рек в Мировой океан оценивается в 3,2 млрд. т/год, следовательно, средняя минерализация речных вод в приустьевых створах составляет 78 мг/л. Таким образом, стекающие с суши речные воды примерно в 4 раза более минерализованы, чем выпадающие на сушу атмосферные осадки, вследствие выщелачивания порядка 0,8 млрд. т/год преимущественно гидрокарбонатных ионов, ионов кальция и магния из растворяемых водой известняковых пород. Этот процесс увеличивает минерализацию в полтора раза и жесткость континентальных водных масс, и более чем вдвое они повышаются из-за концентрирования в стоке растворенных ионов при испарении воды [1].
Несомненно, что вклад испарения и выщелачивания в формирование минерализации речных водных масс сильно варьирует в зависимости от географического положения и ландшафтных особенностей каждого водосбора. Испарение увеличивает минерализацию поверхностных вод с 10-12 до 30 мг/л, а выщелачивание ими грунтов водосбора повышает ее среднее многолетнее значение в 6 раз - до 190 мг/л [1].
Оценка ионного стока с подземными водами показала, что его средняя многолетняя величина может составлять 1,3 млрд. т/год; при суммарном дебите субмариннькк источников (т.е. подводных) 2,4 тыс. км3/год. Средняя минерализация их вод равна 0,6 г/л (в 7,5 раз больше, чем в речном стоке). С учетом этой компоненты ионного стока с суши его общая величина составляет 4,5 млрд. т/год (70 % - поверхностный ионный сток и 30 % - подземный), и она в 10 раз больше, чем солевой поток с Мирового океана на сушу. Разность этих потоков показывает величину химической денудации суши под воздействием стока, равную 4,1 млрд.т/год [1].
Суммарная площадь многочисленных областей внутреннего стока, имеющихся на всех континентах, равна 30 млн. км2, суммарный сток в них речных водных масс очень мал (1 тыс. км3/год). Средний слой стока воды в этих областях, расположенных преимущественно в пустынных ландшафтах, составляет всего 33 мм/год (в 12 раз меньше среднего слоя стока в областях внешнего стока). Вследствие полного испарения воды и частичной дефляции ветром солей и речных наносов водные массы в областях внутреннего стока, испаряясь, формируют континентальные воздушные массы, слабо насыщенные водяным паром, но наиболее обогащенные аэрозольными частицами, которые снова включаются в континентальное звено ГГЦ [1].
Кроме процессов, которые ведут к изменению химического состава воды на континенте (растворение горных пород и продуктов деструкции органического вещества, образующегося в разнообразных ландшафтах), в водах суши многократно увеличивается содержание взвешенных веществ в результате эрозии, которую производят поверхностные склоновые воды, вымывая частички грунта и насыщаясь наносами. В целом на всей части суши, свободной от снежного и ледяного покрова, образуется масса продуктов склоновой эрозии почв и грунтов, составляющая порядка 90 млрд. т/год. Следовательно, средняя мутность поверхностно-склонового стока равна примерно 2 кг/м3, а средний модуль эрозии, не покрытой льдом части суши
Мэр = 90 • 109/133 • 106 = 677 т/(км2 • год) (2)
и в 20 раз превышает модуль химической денудации суши в процессе стока [1].
В отличие от растворенных ионов, которые с водой транзитом проходят по гидрографической сети областей внешнего стока до Мирового океана, большая часть взвешенных частиц грунта лишь перераспределяется стоком в пределах речных водосборов и отлагается по мере выполаживания уклонов сначала склонов, а затем и уклонов рек. О масштабе такой трансформации стока наносов можно судить, сопоставив приведенную выше оценку интенсивности водной эрозии почвенного покрова суши с величиной стока речных наносов в океаны. Такой расчет выполнен по данным многолетних гидрометрических наблюдений за стоком наносов в приустьевых створах 635 рек. Для оценки стока наносов остальных впадающих в океаны рек использован метод аналогии. Суммарный сток наносов с суши получился равным 15,7 млрд. т/год, следовательно, более 80 % продуктов водной эрозии перераспределяется внутри водосборов, формируя делювиальные отложения, русловой и пойменный аллювий, а остальные 20 % выносятся в дельты, бессточные озера и моря. Более поздние оценки величины стока речных наносов в Мировой океан отличаются всего на 5-15%. Учитывая различия методики таких расчетов, можно считать, что они подтверждают, во-первых, малую долю выносимых стоком с суши продуктов ее водной эрозии, а во-вторых, 4-5-кратное превышение стока взвешенных веществ и их средней концентрации над стоком и концентрацией растворенных веществ [1].
Емкость русловой сети всей суши, характеризуемая осредненным объемом находящихся в ней речных водных масс, составляет несколько больше 2 тыс. км3, поэтому среднее время смены водных масс в речной сети - 16 дней, т.е. вдвое продолжительнее, чем смена воздушных масс в атмосфере[1].
Континентальный этап. В глобальном гидрологическом цикле представляет собой процесс перемещения природных вод по поверхности суши (поверхностный сток) и внутри почв и грунтов верхнего слоя литосферы (подземный сток) под действием силы тяжести. Поверхностный сток имеет следующие разновидности: склоновый, русловой и внутриводоемный. В течение года сток имеет многоводные фазы - половодье (повторяется на данной реке из года в год в один и тот же сезон) и паводки (возможны в любое время каждого сезона) и маловодные фазы (межень) [1].
Склоновый сток периодически возникает во время снеготаяния или интенсивных и продолжительных дождей в виде плоскостного стекания воды с относительно ровных, покрытых луговой или лесной растительностью территорий. На оголенных или распаханных склонах оно перестраивается в сток воды по непрерывно изменяющейся микроручейковой сети, переходящий в сеть все более крупных временных ручейков. В этой начальной стадии формирования поверхностного стока его внутрисуточная, синоптическая и сезонная изменчивость изначально определяется неравномерностью выпадения атмосферных осадков вследствие изменения погоды. Сильно изменчив при этом и состав склонового генетического типа вод, обогащающихся смываемыми легко растворимыми солями, минеральными биогенными и органическими веществами (продуктами бактериального разложения отмирающих организмов наземной фло£ы и фауны), а также минеральными и органическими взвешенными веществами, из-за которых эти воды особенно мутны[1].
Одновременно на водосборе начинают формироваться и два других генетических типа вод, образующих подземный сток из фильтрующихся сквозь почву и подстилающие ее грунты склоновых вод и изменяющих при этом свои свойства. Образовавшиеся в результате этой трансформации воды почвенного генетического типа, сильнее и продолжительнее контактирующие с почвенным покровом водосбора, отличаются от склоновых вод несколько большей минерализацией, наибольшим содержанием биогенных и органических растворенных веществ и меньшей концентрацией взвесей. А еще глубже проникающие воды грунтового генетического типа из-за еще более медленного водообмена приобретают наиболее высокую минерализацию и жесткость при минимальном содержании органических, биогенных и взвешенных веществ и нередко при полном отсутствии растворенного кислорода. Если в них много растворенного закисного железа, то при выходе на поверхность в виде источников такие воды заметны по ржавому цвету осадка. Он образуется при насыщении подземной воды на воздухе кислородом, превращающим бесцветное Fe(OH)2 в хлопьевидное Fe(OH)3[1].
Русловой сток возникает, когда воды этих генетических типов, объединяясь в первичную речную водную массу (РВМ), формируют русловую сеть, где смешиваются в различных пропорциях в зависимости от фазы гидрологического режима. В половодье при снеготаянии в умеренных и полярных широтах или в сезон интенсивных дождевых осадков в областях муссонного и тропического климата возникающая в русле первичная РВМ состоит в основном из склоновых вод. В эту самую многоводную фазу водного режима вода в реке имеет соответствующие данному генетическому типу вод характеристики своего физического состояния и химического состава. При этом сильный подъем уровня воды в реке с нередким затоплением поймы создает подпор подземных вод, ограничивающий их поступление в реку. На спаде половодья и в паводки преобладающую роль в формировании первичной РВМ играют воды почвенного генетического типа в сочетании с остатками склонового типа вод и все увеличивающегося притока в речное русло вод грунтового генетического типа [1].
В глубокую летнюю и зимнюю межень, когда реки питаются почти исключительно грунтовым генетическим типом воды из наиболее глубоких водоносных горизонтов грунтовой толщи речного водосбора, солевой состав РВМ подобен химическому составу вод данного генетического типа. Попадая в речную сеть, эти воды быстро насыщаются кислородом. Летом они имеют низкую температуру, вследствие чего растворимость в них атмосферного кислорода велика. В период ледостава они имеют более высокую температуру по сравнению с РВМ, поэтому у их источников часто образуются полыньи - очаги насыщения кислородом зимней речной воды.
По мере продвижения РВМ вниз по реке от истока к устью и изменения расхода воды в потоке непрерывно изменяется в ней соотношение между массой взвешенных и влекомых наносов. Кроме того, от одного речного участка к другому увеличивается объем этой главной РВМ благодаря ее смешению с водными массами все большего числа притоков ее речной системы. Поэтому русловой сток сопровождается как внутримассовой, так и фронтальной трансформацией состава речной воды.
Внутримассовая трансформация РВМ проявляется:
-
в колебаниях температуры речной воды вследствие ее теплообмена с атмосферой, изменяющегося в безледный период года в зависимости от смены погоды;
-
в колебаниях концентрации взвешенных веществ и прозрачности речной воды вследствие ее обмена наносами с русловыми отложениями в плесовых лощинах и на перекатах, у абразионных и аккумулятивных участков речного берега. Направленность этого обмена и его интенсивность изменяются в зависимости от расхода воды и наносов в реке. Особенно сильна такая трансформация в случае выхода воды на пойму, когда происходит заиление ее поверхности и смена водных масс в расположенных на ней нередко многочисленных пойменных озерах и низинных болотах;
-
в постепенном увеличении минерализации речной водной массы в местах дренирования руслом все более глубоких водоносных горизонтов грунтовой толщи речного водосбора;
-
в постепенном росте биомассы фито- и зоопланктона, количества рыбы по мере увеличения времени существования и размера РВМ, в колебании видового состава и численности водных организмов планктона в зависимости от развития в русле высшей водной растительности и ихтиофауны, изменений водности реки и погодных условий в вегетационный период[1].
Фронтальная трансформация РВМ происходит в участках русла, расположенных ниже устьев притоков. В русловой сети каждого из них формируются свои речные водные массы со специфическими характеристиками водности и состава воды, соответствующими ландшафтным условиям формирования стока на водосборе того или иного притока[1].
В пределах участка смешения водных масс притока и главной реки (начало такого участка - в створе устья притока) выделяются по минерализации воды и другим гидроэкологическим характеристикам три зоны (рис. 4) [1].
Две из них, сужающиеся вниз по течению, расположены у противоположных берегов реки, а между ними находится третья -расширяющаяся вниз по течению фронтальная зона. У берега, противоположного устью притока, находится зона, в которой расположена струя главной РВМ, все большая часть которой с удалением от устьевого створа вовлекается во фронтальную зону. У другого берега реки прослеживается струя все более трансформирующейся водной массы притока вследствие смешения с водой расширяющейся фронтальной зоны. А в этой зоне с удалением вниз по течению от устьевого створа все меньше становятся значения поперечного градиента характеристик состава воды. Этот градиент практически совсем исчезает в створе полного смешения обеих РВМ, на нижней границе участка фронтальной трансформации главной водной массы реки [1].
Гидрологическая структура участка смешения РВМ (т. е. соотношение размеров трех зон) и его протяженность до створа полного смешения зависит от руслового рельефа, соотношения расходов воды сливающихся рек и в особенности от водности реки. Чем больше расход воды в ней, тем длиннее этот участок смешения, несмотря на то, что с увеличением расхода нередко возрастает скорость течения и турбулентное перемешивание водных масс. Тем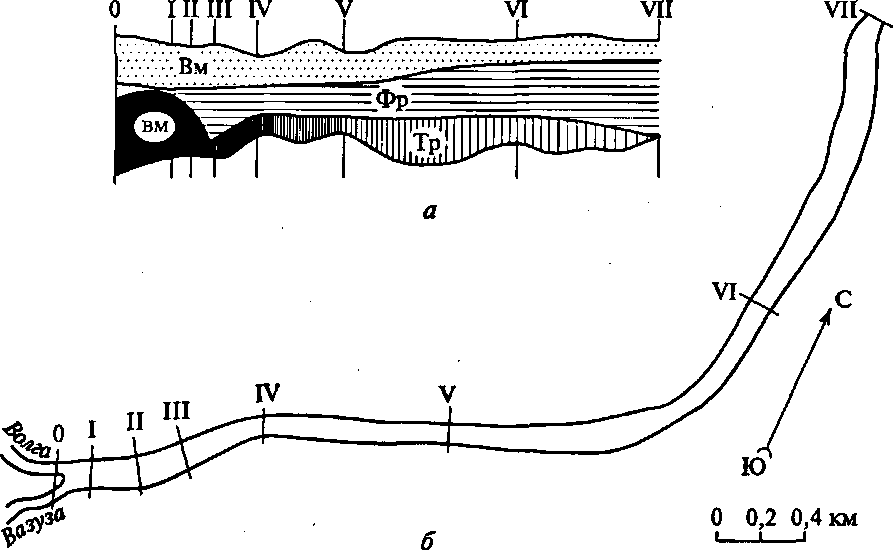 Рис. 4. Схема фронтальной трансформации речной водной массы (а), по материалам русловой съемки в летнюю межень участка смешения (б) речных водных масс Волги (расход ВМ, 34м3/с) и ее притока Вазузы (расход ВМ, 4 м3/с):
Рис. 4. Схема фронтальной трансформации речной водной массы (а), по материалам русловой съемки в летнюю межень участка смешения (б) речных водных масс Волги (расход ВМ, 34м3/с) и ее притока Вазузы (расход ВМ, 4 м3/с):
Тр - зона трансформации водной массы притока; Фр - фронтальная зона; I-VII- номера поперечных створов наблюдений (протяженность участка 4,5 км)
не менее при повышенных скоростях течения возрастает удаленность створа полного смешения от устьевого створа[1].
Наименее консервативна в этом процессе концентрация взвешенных наносов, осаждение и взмучивание которых зависит от изменения динамического режима потока в узле слияния рек[1].
Таким образом, каждая речная водная масса - это смесь генетических типов воды, поступивших в речную систему с ее водосбора в одну из фаз стока. И только в русле главной реки крупной речной системы на стыке фаз стока может наблюдаться явление вытеснения вод прошедшей маловодной фазы водной массой наступившей многоводной фазы (например, вытеснение вниз по реке вод зимней межени водной массой начавшегося половодья) [1].
Внутриводоемный сток. Еще большей трансформации подвергаются континентальные водные массы, поступающие в водоемы суши - пресноводные озера, водохранилища и пруды. Подавляющее большинство таких водоемов проточны, т.е. из них вытекает вода в расположенные ниже участки речной сети. Процесс стока в каждом таком водоеме представлен медленным транзитным стоковым течением, направленным от устьев рек, втекающих в водоем, к истоку вытекающей из него реки[1].
Вследствие замедленного водообмена в водоеме происходит смешение РВМ не только разных рек, но и различных фаз их водного режима (половодья, межени, паводков). В результате их фронтальной трансформации образуется основная {озерная) водная масса (ОВМ), отличающаяся от речных водных масс прежде всего комплексным генетическим составом. Это означает, что каждая водная масса озерного типа представляет собой смесь множества объемов разнородных генетических типов воды, возникших в различных ландшафтах одного или нескольких речных водосборов в 2-3 фазах и более данного года или даже многих предшествующих лет. Благодаря длительному воздействию многообразных внутриводоемных динамических процессов ОВМ даже в самых крупных водоемах мира приобретают пространственно однородные физические, химические и биологические свойства в поверхностном перемешанном слое (эпилимнионе) и глубинном слое (гиполимнионе). Различие неконсервативных характеристик качества воды в этих слоях возникает благодаря внутримассовой трансформации лишь в сезоны летней или зимней стагнации. Эти различия исчезают в периоды полной конвективной циркуляции вод в другие сезоны[1].
Таким образом, чем меньше интенсивность внутриводоемного стока, т.е. проточность водоема, тем более продолжительно время пребывания ОВМ в водоеме, тем сильнее ее внутримассовая трансформация и больше отличие состава воды, вытекающей из водоема в речное русло, по сравнению с составом РВМ, питающих водоем. При этом трансформируются (сильно сглаживаются) и внутригодовые колебания характеристик водного, теплового, химического стока и стока наносов. Поэтому для озерных рек, вытекающих из слабопроточных озер, характерны следующие черты озерного регулирования стока:
а)отсутствие в их внутригодовом водном режиме многоводных и маловодных фаз;
б)постоянство минерализации и химического состава воды,
ее большая прозрачность из-за малой концентрации минеральных
взвесей[1].
В водообмене озер мира участвует в среднем за многолетний период более 2,2 тыс. км3/год речных вод и атмосферных осадков, образующих ежегодно возобновляющиеся динамические водные ресурсы озер. Они составляют всего 1% суммарного объема аккумулированной в озерах воды, равного 176 тыс. км3. Остальные 99% этого объема представляют собой вековые стационарные озерные ресурсы (водные и биологические). Время пребывания воды в озерах разных морфогенетических типов варьирует очень сильно - от нескольких месяцев в сильно проточных водоемах до 300 лет в оз. Байкал, выделяющемся самым замедленным водообменом среди проточных водоемов Земли. Среднее значение времени пребывания воды в озерах мира - около 80 лет[1].
В каждой реке, вытекающей из озера, по мере впадения в нее все большего количества РВМ ее притоков с незарегулированным русловым стоком озерные воды, вследствие фронтальной трансформации, приобретают черты, более свойственные речной водной массе - внутригодовое чередование многоводных и маловодных фаз стока с генетически обусловленным изменением в реке физических, химических и биологических характеристик воды[1].
Завершается континентальный этап ГГЦ метаморфизацией РВМ в устьевой области, где пресная речная вода смешивается с морской водной массой (МВМ). Здесь на стыке континентального и океанического звеньев ГГЦ главную роль в коренном изменении свойств воды играют следующие процессы:
-
прекращение перемещения влекомых наносов и осаждение большей части взвешенных наносов вследствие уменьшения уклона речного потока и скорости течения;
-
фронтальное смешение РВМ с намного большим объемом соленой морской воды, сопровождающееся ее пересыщением карбонатными ионами, кристаллизацией СаСО3 и его осаждением (при участии водных организмов) на дно приустьевого взморья[1].
Аналогичные процессы метаморфизации состава пресных РВМ протекают и в аридных областях внутреннего стока - в солоноватоводных озерах и приустьевых заливах минеральных озер, куда впадают питающие их реки. Здесь особенно ярко проявляется роль испарения в повышении солесодержания ОВМ (до 100 -300 %о и более), превращающейся в рапу, из которой происходит осаждение на дно различных по химическому составу солей[1].
Глава 2. ХИМИЯ КОНТИНЕНТАЛЬНЫХ ВОД, ДЕЛЬТ РЕК И МОРСКОЙ ВОДЫ
2.1. Химия континентальных вод
Континентальные воды очень важны для человека, поскольку они являются единственным надежным источником питьевой воды. Химический состав рек, озер и грунтовых вод сильно варьирует и контролируется преимущественно тремя факторами: химией элементов, режимами выветривания и биологическими процессами. Кроме того, сильное влияние на некоторые системы питьевой воды может оказать воздействие человека [3].
2.1.1. Химия элементов
Двадцать крупнейших рек Земли несут около 40% общего континентального стока. Эти реки дают наилучшее представление о среднем глобальном химическом составе речных вод, который можно сравнить со средним составом континентальной коры. Такое сравнение позволяет выделить три особенности:
-
В растворенном состоянии в химическом составе пресной воды преобладают четыре металла, присутствующие в виде простых катионов (Са2+, Na+, К+ и Mg2+).
-
Концентрация ионов в растворе низка.
-
Ионный состав растворенных веществ в пресной воде принципиально отличается от континентальной коры, несмотря на то, что все катионы в речной воде, за исключением некоторого количества натрия и хлора, являются результатом процессов выветривания.
Различие между составом коры и растворенных веществ речной воды особенно заметно для алюминия и железа по сравнению с другими металлами (табл.1). Такое различие является результатом того способа, каким ионы металлов взаимодействуют с водой [3].
Таблица 1
Сравнение среднего состава основных катионов в породах континентальной коры и речных водах
Катионы
Континентальная кора, мг·кг-1
Речные воды,
мг·кг-1
Алюминий Al3+
80,0
0,05
Железо Fe3+
35,0
0,04
Кальций Са2+
30,0
13,0
Натрий Na+
29,0
5,2
Калий К+
28,0
1,3
Магний Мg2+
13,0
3,4
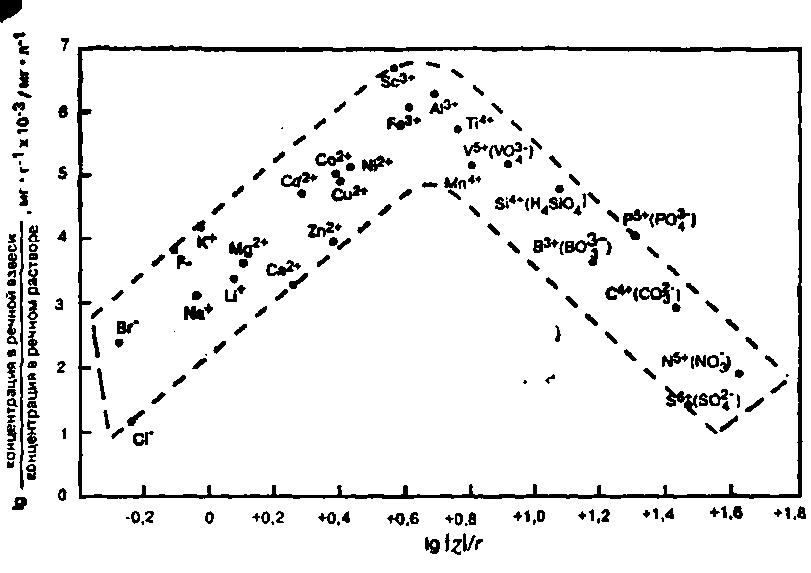 Рис. 4. Зависимость отношения средних концентраций элементов в реках в составе взвеси к содержанию в растворе от отношения заряд/ионный радиус для наиболее распространенных ионов этих элементов. В случае растворенных оксианионов соответственные растворенные формы показаны в скобках.
Рис. 4. Зависимость отношения средних концентраций элементов в реках в составе взвеси к содержанию в растворе от отношения заряд/ионный радиус для наиболее распространенных ионов этих элементов. В случае растворенных оксианионов соответственные растворенные формы показаны в скобках.
Ионные соединения хорошо растворимы в полярных растворителях типа воды. Однако, находясь в растворе, различные ионы вступают в реакции с водой по-разному. Ионы с низким зарядом 1+,2+,1-, 2-) обычно растворяются в виде простых катионов или анионов. Такие ионы слабо взаимодействуют с водой, за исключением того, что каждый из них окружен ее молекулами. Ионы меньшего размера с более высоким зарядом вступают в реакции с водой, притягивая ОН-, и образуют незаряженные и нерастворимые гидроксиды, высвобождая в ходе реакции ионы водорода [3].
Кроме того, небольшие и более высокозаряженные ионы взаимодействуют с водой с образованием относительно больших и устойчивых ионов (так называемых оксианионов), например сульфата (S042-), путем притягивания ионов кислорода и опять же высвобождая ионы водорода [3].
Конечный результат заключается в образовании больших анионов, легко растворяющихся вследствие того, что заряд распределен по большому периметру иона. Общий характер растворимости элементов можно объяснить сточки зрения заряда и ионных радиусов (z/r) (рис. 4). Ионы с низкими значениями z/r высокорастворимы, образуют в растворе простые ионы, и ими обогащена фаза раствора речной воды по сравнению с фазой взвеси. Ионы со средними значениями z/r относительно нерастворимы и имеют сравнительно большие отношения частица: раствор в речной воде. Ионы с большими значениями z/r образуют комплексные оксианионы и снова становятся растворимыми [3].
2.1.2. Химия воды и режимы выветривания
Химия рек различна, и большинство различий обусловливается режимами выветривания.
Состав растворенных ионов в пресных водах зависит от:
- варьирующего состава дождевых осадков и сухих атмосферных выпадений;
- изменений в поступлениях в атмосферу вследствие эвапотранспирации;
- варьирующих вкладов от реакций выветривания и разложения органического вещества в почвах и породах и различного вовлечения в биологические процессы в почвах. Там, где присутствуют кристаллические породы или сильно выветрелые тропические почвы (т. е. в местах, где вклад от выветривания низок или исчерпан), химия растворенных веществ в пресных водах в основном зависит от природных поступлений в атмосферу, например, морских брызг и пыли, а также антропогенных газов, например SО2 [3].
Поступления морской соли, обычно называемые, цикличной солью, характерны для прибрежных областей. Небольшие количества морской соли, однако, присутствуют также в речной воде центральных континентальных областей, удаленных на тысячи километров от моря.
Поступления морской соли в целом имеют сходный, в основном натрий хлоридный (NaCl), химический состав с той морской солью, из которой они происходят. Таким образом, ионы натрия или хлора могут быть использованы в качестве меры поступления морских солей в речные воды[3].
Роль морской воды как источника остальных ионов для дождевой воды можно оценить, рассчитав их относительное содержание по отношению к натрию и сравнив его с таким же отношением в морской воде. Такое сравнение можно распространить и на пресную воду, хотя здесь существует то осложнение, что некоторые ионы попадают в нее при выветривании. Если с самого начала не учитывать этого осложнения, то в областях, где поступления дождевой воды вносят большой вклад в химию пресной, доминирующим катионом, вероятнее всего, будет Na+. Если существенны процессы выветривания, основными растворенными ионами будут те растворимые элементы, которые поступают из местной породы и почвы. В отсутствие минералов-эвапоритов, которые являются второстепенными компонентами континентальной коры (рис.5) наиболее легко выветриваемыми породами являются известняки (СаСО3). Ион кальция, высвобождаемый в процессе растворения известняка, выступает в качестве индикатора такого процесса выветривания. Отсюда отношение Na+ : (Na+ + Са2+) можно использовать для разграничения источников ионов для пресной воды - дождевого и процессов
выветривания. Когда доминирующим катионом является натрий (существен вклад морской соли), значения Na+ : (Na+ + Са2+) приближаются к 1. Когда преобладает кальций (существен вклад процессов выветривания), значения Na+ : (Na+ + Са2+) приближаются к 0 [3].
Состав растворенных ионов в речной воде можно классифицировать, сравнивая значения Na+ : (Na+ + Са2+) с общим количеством ионов, присутствующих в растворе (рис. 5). Данные, представленные внизу справа на рис. 5, относятся к рекам с низкими концентрациями ионов и натрием как преобладающим катионом. Эти реки текут по кристаллической материнской породе (низкие скорости выветривания) или по сильно выветрелым каолинитовым тропическим почвам (низкий потенциал выветривания) [3].
Основные речные системы протекают по разнообразным типам пород, захватывая растворенные продукты реакций выветривания. Пресные воды, происходящие из областей с активными процессами выветривания, имеют наиболее высокие концентрации ионов, в них также увеличивается преобладание кальция над натрием. Эти реки нанесены вдоль направления А-А' на рис. 5 [3].
В аридных районах на химию основных растворенных ионов рек влияет испарение. Испарение увеличивает общее количество ионов в речной воде. Оно также вызывает осаждение из воды СаСО3 раньше, чем NaCl, поскольку последний более растворим. Из-за образования CaCO3 из воды удаляется ион кальция, что увеличивает отношение Na+ : (Na+ + Са2+). Данные для рек, на которые влияет испарение, нанесены вдоль диагонали В-В' на рис. 5, и состав их приближается к составу морской воды [3].
Классификация состава речной воды, приведенная на рис. 5, является упрощенной и не всегда соответствует действительности. Например, в результате выветривания полевых шпатов могут образовываться растворы с низкой ионной силой, но в то же время богатые натрием и кремнием, которые помещаются внизу справа на рис. 5. На состав рек может также влиять выветривание минералов-эвапоритов. Последние имеют очень высокие общие концентрации катионов и характеризуются высокими содержаниями натрия, хлора, кальция и сульфатов из-за выветривания минералов-эвапоритов - галита и гипса. Несмотря на эти отклонения, рис.5 остается удобным для сравнения факторов, контролирующих химию речной воды. Удивительно, что состав большинства крупных рек мира может быть рационально описан таким прямолинейным способом [3].
![]() 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
Весовое отношение Na/(Na+Ca)
Рис. 5. Изменение весового отношения Na/(Na+Ca) в зависимости от общего содержания растворенных твердых веществ и ионной силы для поверхностных вод. Стрелки показывают эволюцию химического состава от истока и вниз по течению.
Наконец, напомним, что большинство почвенных вод, питающих реки и грунтовые воды, имеют околонейтральный рН и HCO3- в виде основного аниона. Это является результатом растворения СО2 в воде и кислотного гидролиза силикатов и карбонатов. Общее количество слабых анионов в воде часто относят к щелочности, и они поддерживают значение рН около 8 [3].
2.1.3. Кремний и алюминий
Кремний мобилизуется при выветривании силикатов и переносится в природных водах в виде недиссоциированной кремниевой кислоты, H4SiO4. Силикаты выветриваются медленно, поэтому скорости поступления (и концентрации) кремния в большинстве пресных вод очень низкие. Несмотря на это, в местах, где силикаты являются основным компонентом подстилающей породы или почвы, H4SiО4 может быть важной составляющей среди растворенных твердых веществ пресных вод [4].
Алюминий как правило не растворяется в процессах выветривания (табл.1), однако становится растворимым при низких и высоких значениях рН. В простейшем случае различаются три формы алюминия: растворимый Аl3+, преобладающий в кислых условиях, нерастворимый гидроксид алюминия [A1(OH)3], преобладающий в нейтральных условиях, и [Al (OH)3], преобладающий в щелочных условиях [4].
Таким образом, растворимость алюминия зависит от рН, он нерастворим в пределах значений рН 5-9, что включает большинство природных вод. Растворимость алюминия осложняется образованием частично диссоциированных форм А1(ОН)3 и комплексов между алюминием и органическим веществом. Понимание контроля за растворимостью алюминия важно, поскольку его токсичность может вызвать гибель рыбы в подкисленных пресных водах [4].
Подкисление пресных вод происходит в том случае, если скорость замещения почвенных катионов водородом (Н+) превышает скорость поступления катионов в результате выветривания. Реакции ионного обмена помогают поддерживать рН короткое время, но для более длительных периодов снабжение почвы катионами осуществляется из нижележащей подстилающей породы. Обычно дождевая вода имеет кислую реакцию, и почвенные воды дополнительно подкисляются из-за образования Н+ в результате разложения органического вещества. Таким образом, подкисление может быть природным процессом, хотя кислотные дожди сильно увеличили скорости этих процессов во многих районах земли [4].
Подкисление пресной воды особенно заметно в горных областях с большим количеством дождевых осадков (и, следовательно, высоким потоком кислоты), на крутых склонах (где результатом является короткое время пребывания воды в почве) и кристаллических породах, где медленны процессы выветривания и снабжения катионами. Несмотря на то, что кислотные дожди являются широко распространенным явлением, подкисленные пресные воды встречаются не так часто и контролируются как скоростью поступления из атмосферы, так и типом пород. В процессе всех реакций выветривания, за исключением окисления сульфидов, потребляются ионы водорода, смещая рН в нейтральную область. Следовательно, древние реки, дренирующие мощные, богатые катионами почвы низин, имеют более высокий рН и более низкие концентрации алюминия [4].
Хотя алюминий растворим при высоких рН, щелочные воды не распространены, поскольку они адсорбируют из атмосферы кислые газы, например С02 и S02. Однако реки с щелочной реакцией и подвижным алюминием известны. Промышленный процесс получения алюминия из боксита включает выщелачивание металла сильными растворами гидроксида натрия (NaOH). Значение рН для химии воды хорошо демонстрируется также процессами загрязнения грунтовых вод [4].
2.1.4. Биологические процессы
В ручьях и небольших реках биологическая активность в воде слабо влияет на ее химический состав, поскольку любые воздействия устраняются из-за быстрого течения. Напротив, в крупных реках и озерах со слабым течением основные изменения в химическом составе воды могут быть вызваны биологической активностью [3].
Все фотосинтезирующие растения поглощают свет и превращают его в химическую энергию с помощью молекулы хлорофилла. Освобождаемая энергия используется затем для превращения СО2 (или HCO3-) и воды в органическое вещество следующим образом:
свет
СН2О(тв) + О2(г) → СО2(г) + Н2О(ж) (3)
СН2О представляет собой обобщенную формулу для углеводного органического вещества. Протекание реакции, обозначенной уравнением, требует притока энергии (∆G° = +475 кДж • моль-1), что обеспечивается светом. В мелких пресных водоемах фотосинтез осуществляют крупные растения и дрейфующие микроскопические водоросли (фитопланктон), в то время как в глубоких озерах (и океанах) практически весь фотосинтез происходит только за счет фитопланктона. В процессе обратной реакции разложения органического вещества, т. е. окисления или дыхания, высвобождается энергия, которая поддерживает жизнь:
СН2О(тв) + О2(г) → СО2(г) + Н2О(ж)
∆G° = - 475 кДж • моль-1 (4)
Поскольку фотосинтез требует света, он сосредоточен в поверхностных слоях воды - эуфотической зоне (область, получающая >1% излучения, попадающего на поверхность воды). Глубина эуфотической зоны варьирует в зависимости от положения солнца, количества света, абсорбируемого взвешенным веществом (включая фитопланктон) и наличия в воде растворенных окрашенных соединений [3].
Разложение органических веществ (которое практически всегда осуществляется при участии бактерий) может происходить на любой глубине столба воды. В процессе разложения потребляется кислород [уравнение (4)], который поступает воду в большой степени путем обмена газов на границе вода/воздух и частично - как побочный продукт фотосинтеза. Количество кислорода, способного раствориться в воде, зависит от температуры. Насыщенная кислородом пресная вода содержит около 450 мкмоль • л-1 кислорода при 1°С и 280 мкмоль • л-1 при 200С [3].
В летний период приповерхностные слои многих озер нагреваются лучами солнца. Более теплые приповерхностные воды являются менее плотными, чем холодные глубинные, и это приводит к устойчивому расслоению по плотности. Такая стратификация ограничивает обмен между обогащенными кислородом поверхностными водами и глубинными водами.
Органическое вещество, образующееся в поверхностных водах, опускается в глубинные воды, где оно окисляется, еще более понижая концентрацию кислорода. В некоторых случаях содержание кислорода падает ниже уровня, необходимого для поддержания жизни животных. Скорость потребления кислорода увеличивается по мере того как возрастает количество поступающего органического вещества по причине как усиленного фотосинтеза в поверхностных водах, так и из-за прямого стока органических отходов, т. е. сточных вод [3].
В том случае, если кислород израсходован, бактерии используют другие окисляющие агенты для потребления органического вещества. Эти альтернативные окислители используются в порядке, зависящем от выхода энергии. Восстановление нитратов (денитрификация) энергетически выгодно бактериям, но в природных пресных водах оно обычно ограничено из-за низких концентраций нитратов. Однако в результате антропогенного привноса концентрации нитратов в реках и подземных водах возросли, что увеличило доступность нитратов для восстановления бактериями [3].
Восстановление сульфатов в пресных водах не служит значительным механизмом потребления органического вещества, поскольку уровень растворенных сульфатов там обычно низкий. Однако в морской воде сульфатов много, и процесс их восстановления очень важен. В некоторых богатых органическим веществом речных и болотных осадках существенным деструкционным процессом может быть метаногенез. Известно, что восстановленный продукт реакции, метан (СН4), являющийся парниковым газом, выделяется в виде пузырей из некоторых заболоченных земель, включая рисовники, что вносит значительный вклад в резервуар атмосферного СН4 [3].
2.1.5 Питательные вещества и эвтрофикация
Кроме СО2, воды и света растениям для роста нужны определенные ионы (питательные вещества). Некоторых из этих ионов, например Mg2+, довольно много в пресной воде, однако другие необходимые питательные вещества, например азот (N) и фосфор (Р), присутствуют в низких концентрациях. Если недостаток света не ограничивает рост водорослей, то может иметь место химическое ограничение роста, когда потребность в азоте и фосфоре начинает превышать их доступность. Поэтому на поведении азота и фосфора в природных водах и их роли как потенциальных или актуальных лимитирующих питательных веществах было сосредоточено большое внимание. В морской воде атомное отношение азота к фосфору, необходимое для оптимального роста, хорошо известно и составляет 16:1. В пресных водах требуемое отношение азот : фосфор варьирует сильнее [3].
В природных водах растворенный неорганический фосфор (РНФ) присутствует преимущественно в виде различных продуктов диссоциации фосфорной кислоты (Н3РО4). В почвах фосфор обычно удерживается в результате осаждения нерастворимых фосфатов кальция и железа, адсорбции на гидроксидах железа или адсорбции на частицах почвы. Таким образом, РНФ в реках возникает в основном из-за прямых разгрузок, например, сточных вод. Концентрации РНФ изменяются обратно пропорционально потоку воды (рис. 6), и привнесенное его количество разбавляется в условиях быстрого потока. Поскольку в отложениях фосфор присутствует обычно в виде нерастворимого фосфата железа (III) (FePО4), в восстановительных условиях (например, таких, какие встречаются в отложениях, когда потребление кислорода превышает его поступление) РНФ может вернуться в столб воды при восстановлении железа (III) до железа (II) [3].
Химия азота сложна, поскольку азот может присутствовать в нескольких окисленных состояниях, из которых N(0) - газ азот (N2), N(3-) - аммоний (NH4+) и N(5+) - нитрат (NО3-) являются наиболее важными. Газообразный азот, растворенный в речной воде, не может быть использован большинством высших растений и водорослей как источник азота, поскольку они не могут разорвать его сильную тройную связь [3].
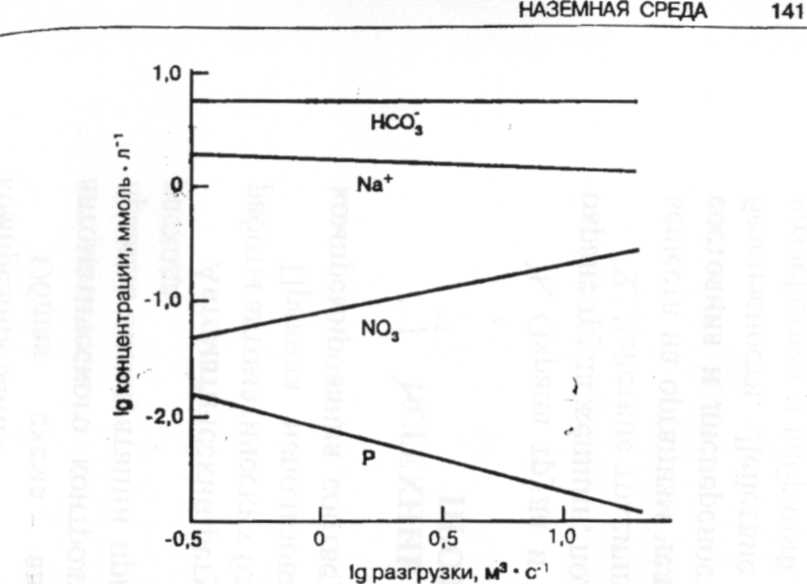 Рис. 6. Взаимосвязь между концентрацией растворенного железа и разгрузкой в реки.. Прямой сброс фосфора из сточных вод, а также из продуктов выветривания (НСОз и Na+) уменьшается по концентрации (разбавляется) по мере увеличения разгрузок. Напротив, сильные дожди выщелачивают NO3- из почвы, приводя к возрастанию концентрации NO3 с увеличением разгрузок.
Рис. 6. Взаимосвязь между концентрацией растворенного железа и разгрузкой в реки.. Прямой сброс фосфора из сточных вод, а также из продуктов выветривания (НСОз и Na+) уменьшается по концентрации (разбавляется) по мере увеличения разгрузок. Напротив, сильные дожди выщелачивают NO3- из почвы, приводя к возрастанию концентрации NO3 с увеличением разгрузок.
Существуют особые «азотфиксирующие» бактерии, использующие N2, однако это энергетически невыгодный путь получения азота. Следовательно, такие микроорганизмы получают преимущество только тогда, когда N2 является единственным доступным источником азота. Тем не менее, наряду с фиксацией N2 молниями азотфиксирующие микроорганизмы обеспечивают основной природный источник азота в реках [3].
В биологических процессах азот используется в состоянии 3-, в основном в виде аминогрупп белков. Это окислительное состояние предпочтительно для поглощения водорослями, а также является формой, в которой азот высвобождается в процессе разложения органического вещества, в основном в виде NH4+. Однажды попав в почвы или воды, NH4+, будучи катионом, может быть адсорбирован на отрицательно заряженных пленках органического вещества, покрывающих почвенные частицы или поверхностях глинистых минералов. Аммоний потребляется также высшими растениями или водорослями или же окисляется до NO3- - этот процесс обычно катализируется бактериями [3].
В отличие от NH4+, NО3- является анионом, который растворим и не удерживается в почвах. Поэтому NО3- дождевой воды или из удобрений, а также появляющийся в результате окисления почвенного органического вещества и отходов животных вымывается из почв в реки. Помимо биологической ассимиляции, денитрификация в средах с низким содержанием кислорода является наиболее важным путем, посредством которого нитраты удаляются из почв, рек и подземных вод. По существующим оценкам, в реках северо-западной Европы половина общего прихода азота в дренирующие воды теряется в результате процесса денитрификации до того, как эти воды достигают моря. Таким образом, в условиях низкого окислительно-восстановительного потенциала РНФ мобилизуется в результате восстановления железа (III), а NО3- теряется, что подчеркивает важность окислительно-восстановительных процессов в химии окружающей среды [3].
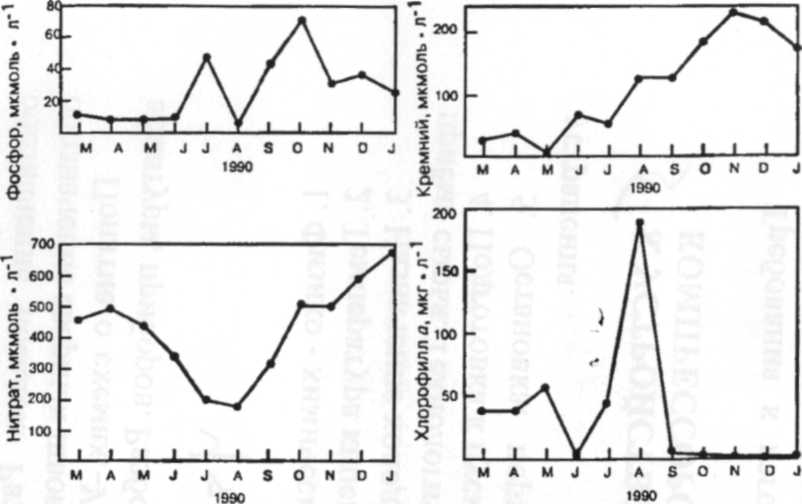 Рис. 7. Сезонные изменения концентрации растворенных фосфора, кремния, нитратов и хлорофилла а взвеси (как меры количества фитопланктона)
Рис. 7. Сезонные изменения концентрации растворенных фосфора, кремния, нитратов и хлорофилла а взвеси (как меры количества фитопланктона)
Крайне различный химизм РНФ и NО3- может быть проиллюстрирован поведением их в подземных водах. Сезонные колебания концентраций NО3- во многих реках умеренной зоны вызваны флуктуациями в поступлении NО3- из почв. В летний период концентрации NО3- низки, поскольку приток дождевой воды в почвенные воды незначителен. Осенью содержание почвенной влаги увеличивается, способствуя вымыванию нитратов из почвы в реки (рис. 7) [3].
Увеличение как площади, так и интенсивности сельскохозяйственной деятельности может быть вероятной причиной возросших концентраций NО3-. Искуственно возросшие концентрации NO3- привели к тому, что РНФ является теперь основным питательным веществом, лимитирующим рост растений во многих пресных водах. Увеличение водорослевой биомассы может привести к токсичности, засорению водных фильтров, неприглядности водоемов, снижению биоразнообразия и низким концентрациям кислорода в стратифицированных водах - к процессу, обычно называемому эвтрофикацией. Взаимосвязь между РНФ и уровнем хлорофилла а (мерой водорослевой биомассы) (рис. 8) придает особое значение наблюдению за поступлением фосфора в реки и озера [3].
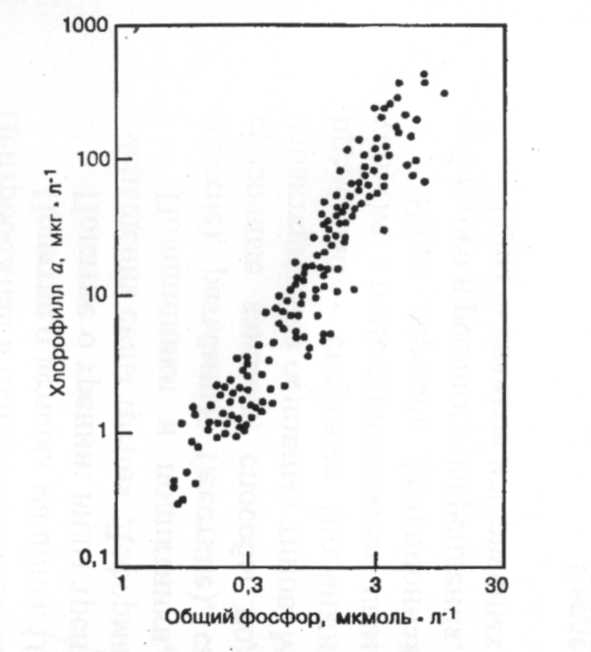 Рис. 8. Взаимосвязь между весенним уровнем хлорофилла а во взвеси (как меры количества фитопланктона) и общей концентрацией фосфора в различных озерах. Данные представлены в логарифмическом масштабе.
Рис. 8. Взаимосвязь между весенним уровнем хлорофилла а во взвеси (как меры количества фитопланктона) и общей концентрацией фосфора в различных озерах. Данные представлены в логарифмическом масштабе.
Другое важное питательное вещество, кремний, используется диатомеями (группа фитопланктона) для построения их экзо-скелета. Диатомеи способны к быстрому и обильному росту в богатых питательными веществами условиях. В реках умеренных областей цветение диатомовых водорослей происходит в начале года. Например, уровень содержания кремния падает ранней весной с началом роста диатомовых водорослей и вновь повышается летом, когда диатомеи вытесняются другими группами водорослей (рис. 7). В богатых нитратами реках (азот: фосфор около 30:1 зимой), биологическая продукция изначально мало влияет на уровни NO3- вплоть до более позднего времени года, когда поступление NO3- уменьшается из-за пониженного стока. Минимума содержание NO3- достигает летом, а потом вновь возрастает осенью (рис. 7). Концентрациям РНФ, напротив, свойственно более непостоянной поведение (рис.7), отражающее влияние биологического контроля и процессов разбавления, но они, в общем, более высоки в летний период в условиях слабого потока воды. Поскольку поступление кремния происходит в основном в результате реакций выветривания, его природно-низкие концентрации могут сильно уменьшаться во время цветения диатомей, до такой степени, что дальнейший их рост тормозится. Таким образом, кремний ограничивает разнообразие видов, но не общую биомассу фитопланктона [3].
2.1.6. Загрязнение подземных вод
Подземные воды крайне важны для человека, поскольку это основной источник питьевой воды. Например, в США более 50% населения использует подземные воды как источник питьевой воды. Поэтому качество грунтовых вод становится очень важным фактором, и в большинстве развитых стран вода для потребления человеком должна соответствовать определенным стандартам. Грунтовые воды могут не соответствовать стандартам качества воды, поскольку содержат растворенные составляющие, появляющиеся как из природных, так и антропогенных источников. Типичные механизмы антропогенного загрязнения подземных вод приведены на рис. 9. Основную угрозу для подземных вод составляет утечка из подземных цистерн, сток отходов из канализаций, сток с сельскохозяйственных полей, мест захоронения городских отходов, а также заброшенных хранилищ вредных отходов. К наиболее часто упоминаемым загрязнителям, поступающим из этих источников, относятся нитраты, пестициды, летучие органические соединения, бензопродукты, металлы и синтетические органические химикаты [4].
Химия загрязненных подземных вод мало отличается от химии поверхностных вод. Однако процессы разложения, происходящие в течение дней или недель в поверхностных водах, могут занимать десятилетия в подземных водах с низкими скоростями потока и слабой микробиологической активностью. Это ограничивает возможность природной очистки посредством вымывания или биологического потребления. Однажды загрязненные подземные воды восстановить сложно и дорого, а во многих случаях невозможно. Местоположения старых участков загрязнения могут быть известны не точно или даже вообще неизвестны, а гидрологические условия могут способствовать разгрузке загрязненных подземных вод в виде природных ключей в реки и озера, в результате которой загрязнение распространяется на поверхностные воды [4].
2.2. Процессы в дельтах
Океаны, безусловно, являются крупнейшими резервуарами гидросферы и существуют по меньшей мере уже 3,8 миллиардов лет. Жизнь на Земле, вероятно, возникла в морской воде, и океаны важны для смягчения колебаний глобальной температуры. Речные воды, дренирующие сушу континентов, попадают в океаны через дельты. Здесь пресные воды смешиваются с морской водой. Химический состав морской воды сильно отличается от состава пресной, и это различие оказывает влияние на транспорт некоторых растворенных и твердых компонентов. Кроме того, человек часто нарушает природные химические процессы прибрежных областей, как посредством загрязнения потока пресной воды, так и за счет хозяйственной деятельности, сосредоточенной вблизи дельт и мелких морей [3].
Мы начнем с рассмотрения химии морской воды вблизи континентальных областей - в переходной зоне между средами обитания суши и открытого океана.
Существует много различий между химизмом континентальных поверхностных вод и морской водой. В частности, морская вода обладает гораздо большими концентрациями ионов натрия и хлора (Na+ и С1-) (табл. 2) в отличие от континентальных вод с преобладанием бикарбоната кальция. Морская вода является настолько концентрированным химическим раствором, что смешивание только 1 % (по объему) морской воды с речной водой среднего состава дает раствор, где отношение между большинством ионов практически такое же, как в морской воде. Таким образом, химические градиенты в дельтах очень высоки и относятся к ранним стадиям перемешивания [3].
Таблица 2
Состав основных ионов в пресной и морской воде в ммоль·л-1
Ионы
Речная вода
Морская вода
Na+
0,23
470
Mg2+
0,14
53
K+
0,03
10
Ca2+
0,33
10
HCO3-
0,85
2
SO42-
0,09
28
Cl-
0,16
550
Si
0,16
0,1
Кроме высокого градиента по ионной силе, в некоторых дельтах существует также градиент по рН.
Однонаправленный поток в реках заменяется на приливно-отливные (обратные) потоки в дельтах. Во время полной и малой воды скорость течения падает до нуля, что позволяет осаждаться и откладываться более 95% тонкозернистого взвешенного осадка (в основном представленного глинистыми минералами и органическим веществом). Эффективность дельт как ловушек для осадка, вероятно, изменялась в течение достаточно коротких геологических временных масштабов. Например, в течение последних 11000 лет, когда уровень моря поднялся вслед за последним оледенением, дельты, по-видимому, наполнились осадком, отработанным с континентальных шельфов. В масштабе геологического времени дельты можно рассматривать как временные явления, но и сегодня это не уменьшает их значения как ловушек для речного взвешенного материала [3].
2.2.1. Агрегация коллоидного материала в дельтах
Высокий градиент ионной силы в воде дельт приводит к дестабилизации коллоидного материала (т. е. суспензии тонкозернистого материала), вызывая его флоккуляцию и выпадение на дно. Лучше можно понять этот процесс на примере глинистых минералов - наиболее распространенных неорганических коллоидов в дельтовых водах. Глинистые минералы несут на поверхности отрицательный заряд, частично компенсированный адсорбированными катионами. Если поверхностные заряды не нейтрализованы путем адсорбции ионов, глинистые минералы проявляют тенденцию к сохранению состояния взвеси, поскольку одноименные заряды отталкиваются. Эти силы отталкивания велики по сравнению с силами притяжения Ван-дер-Ваальса и предотвращают аггрегирование и выпадение частиц. Следовательно, какой-либо агент, нейтрализующий поверхностные заряды, будет способствовать флоккуляции частиц. Многие коллоиды флоккулируют в среде электролита, и морская вода - гораздо более сильный электролит, чем речная, - выполняет эту роль в дельтах. Катионы морской воды притягиваются к отрицательно заряженным поверхностям глин. Они формируют в растворе подвижный слой, примыкающий к поверхности глин (рис.10), и образующийся комбинированный «электрический двойной слой» близок к состоянию электронейтральности. Соседние частицы могут после этого приближаться друг к другу и агрегировать. В природе такое простое объяснение в значительной мере осложняется присутствием органических и гидроксидных пленок на частицах[3].
Отложение осадка в дельтах локализовано в областях с низкой соленостью за счет физических и химических эффектов, обсужденных выше. Осадок, однако, постоянно возвращается в суспендированное состояние вследствие приливно-отливных течений, которые движутся вверх во время прилива и вниз во время отлива. Конечный эффект заключается в образовании областей с высокой концентрацией взвешенного твердого вещества, известных как максимумы мутности. Максимум мутности является важной областью, поскольку многие реакции в химии окружающей среды включают обмен формами между растворенными и твердыми фазами. Такие реакции могут оказать существенное влияние на потоки речного материала в океаны и поэтому должны быть количественно оценены в целях понимания глобального цикла элементов [3].
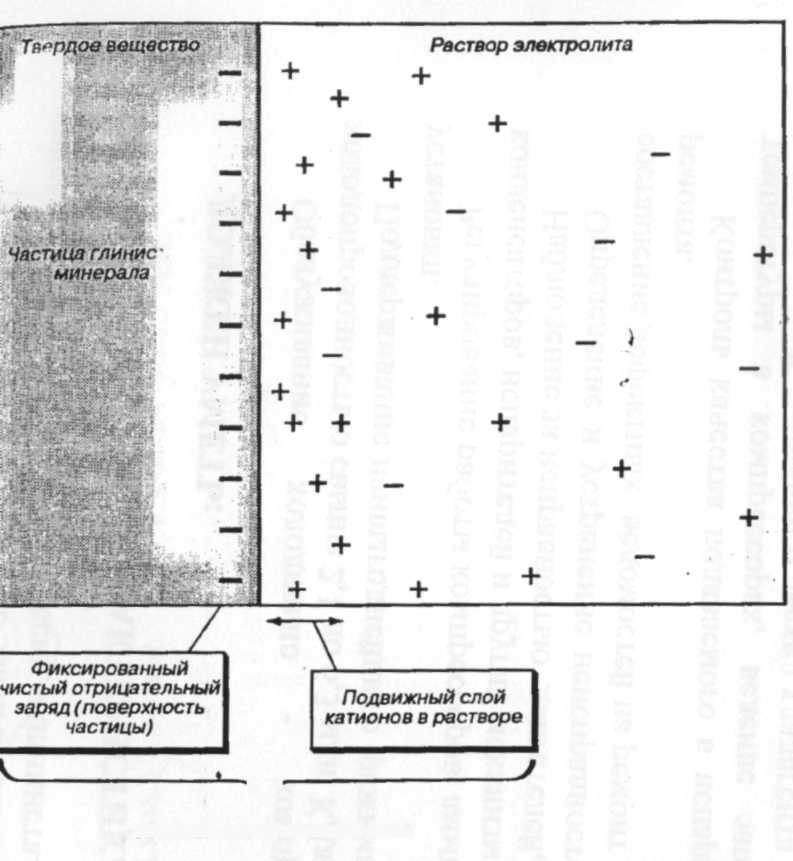 Рис. 10. Двойной электрический слой, включающий в себя неподвижный слой отрицательных зарядов на частице и подвижный слой ионов из раствора. Последний присутствует вследствие притяжения положительно заряженных ионов* к поверхности частицы. Заметим, что с увеличением расстояния от поверхности частицы раствор приближается к состоянию электронейтральности.
Рис. 10. Двойной электрический слой, включающий в себя неподвижный слой отрицательных зарядов на частице и подвижный слой ионов из раствора. Последний присутствует вследствие притяжения положительно заряженных ионов* к поверхности частицы. Заметим, что с увеличением расстояния от поверхности частицы раствор приближается к состоянию электронейтральности.
2.2.2. Процессы перемешивания в дельтах
Поток воды в дельтах не однонаправлен; он подвержен обратным течениям во время приливов. В результате не существует постоянной связи между фиксированной географической точкой и свойствами воды (например, концентрацией иона кальция, Са2+). По этой причине данные, полученные в дельтах, обычно сравнивают с соленостью, а не местоположением. В основе лежит допущение, что соленость в дельте - это просто результат физического перемешивания, а не химических изменений. Если в дельту впадает только одна река и не существует другого источника, то поведение любого компонента можно оценить, построив зависимость его концентрации от солености [3].
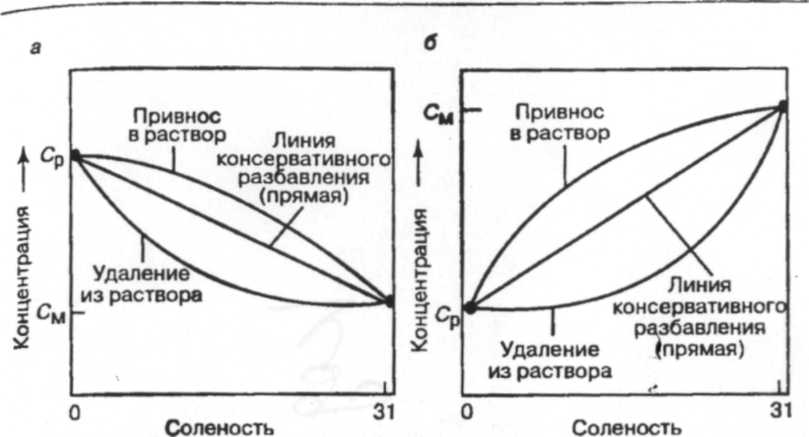 Рис. 11. Идеализированные графики перемешивания в дельтах рек, иллюстрирующие консервативное и неконсервативное перемешивание. Ср и См - концентрации ионов в речной и морской воде соответственно.
Рис. 11. Идеализированные графики перемешивания в дельтах рек, иллюстрирующие консервативное и неконсервативное перемешивание. Ср и См - концентрации ионов в речной и морской воде соответственно.
Если концентрация измеряемого компонента, как и соленость, контролируется простым физическим перемешиванием, их взаимосвязь будет линейной (рис.11). Такое поведение называется консервативным и может иметь место при концентрациях в речной воде больших или меньших, чем в морской воде (рис.11). В отличие от этого, если добавлен компонент, не имеющий отношения к изменению солености, экспериментальные данные будут располагаться выше линии консервативного перемешивания (рис.11). Аналогично, если произошло удаление компонента, данные будут располагаться ниже линии консервативного перемешивания (рис.11). В большинстве случаев удаление или привнос компонента происходит при низких значениях солености, и данные приближаются к консервативной линии при высокой солености. Экстраполяция такой «квазиконсервативной линии» к нулевой солености может обеспечить, путем сравнения ее с измеренной концентрацией нулевой солености, оценку степени удаления или высвобождения компонента [3].
2.2.3. Гальморолиз и ионный обмен в дельтах
Электрохимические реакции, которым подвергаются глинистые минералы речного происхождения, привнесенные в морскую воду, не заканчиваются флоккуляцией частиц или осаждением агрегатов. Способность глинистых минералов к ионному обмену означает, что их транспорт из речной воды с низкой ионной силой и доминированием Са2+ и HCO3- в морские воды с высокой ионной силой и преобладанием хлорида натрия (NaCl) требует протекания реакции с новым раствором для восстановления химического равновесия. Процесс, с помощью которого материал суши приводится в соответствие с морскими условиями, был назван «гальморолизом»; термин происходит от греческих корней hali (море) и myros (мазь), буквально, «смазываться с морем». Понятие гальморолиза определено неточно, однако будем считать, что он включает в себя все те реакции, которые оказывают влияние на частицу в океане до захоронения ее в виде осадка [4].
Многочисленные измерения катионного обмена на речных глинах в морской воде показали, что глинистые минералы обменивают адсорбированный Са2+ на ионы натрия (Na+), калия и магния (Mg2+) из морской воды. В целом компоненты, обладающие высоким сродством к твердым фазам, такие, как растворенный фосфор (Р) или железо (Fe), удаляются из раствора. Таким образом, правила поведения ионов, вытекающие из рассмотрения отношений заряд/ионный радиус (z/r), полезны в понимании химического поведения в дельтах, также как и при процессах выветривания [4].
2.2.4. Микробиологическая деятельность в дельтах
Как и в большинстве природных сред, биологические, а особенно, микробиологические процессы имеют большое значение в дельтах. Во многих дельтах высокие концентрации твердых частиц делают воду слишком мутной, что не позволяет развиваться фитопланктону. Однако в мелководных дельтах или в дельтах с низкой мутностью, а также у их направленных к морю окраин, где концентрации взвешенных твердых частиц низкие, степень освещения может быть достаточной для поддержания роста фитопланктона. Дельты часто дают защищенные укрытые гавани, обычно являющиеся центрами торговли и коммерции. В результате в развитых и развивающихся странах берега дельт часто служат местом расположения крупных городов. Слив отходов и особенно сточных вод населением этих городов приводит к увеличению концентрации питательных веществ, и в местах, где достаточно света, имеет место большая первичная продукция. В динамичной среде дельты разбавление ее богатой фитопланктоном воды удаленными от берега водами с низким содержанием фитопланктона происходит с большей скоростью, чем могут расти клетки (популяции фитопланктона при оптимальных условиях удваиваются во временном масштабе, равном дню или около того). Таким образом, рост популяций фитопланктона часто ограничивается скорее этим процессом разбавления, чем доступностью света или питательных веществ [4].
Степень выноса питательного вещества, которая может иметь место в дельте, проиллюстрирована для силикатов SiО2 (рис. 12). Здесь существует ряд параметров, значения которых свидетельствуют о роли фитопланктона в удалении питательных веществ. В основном удаление силикатов связано с
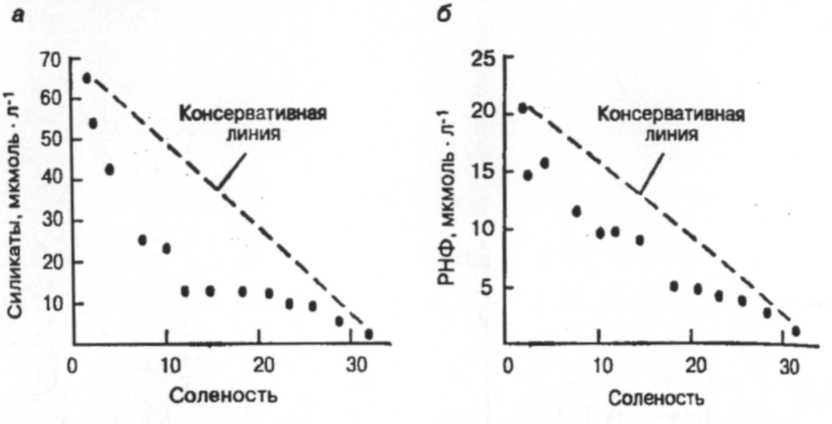 Рис. 12. График зависимости концентрации растворенных силикатов (а) и растворенного неорганического фосфора (РНФ) (б) от солености, на котором показано неконсервативное удаление.
Рис. 12. График зависимости концентрации растворенных силикатов (а) и растворенного неорганического фосфора (РНФ) (б) от солености, на котором показано неконсервативное удаление.
высокими концентрациями хлорофилла во взвешенных частицах, перенасыщением кислородом (возникающим в результате фотосинтеза) и выносом других питательных веществ. В зимний период, когда уровни хлорофилла низки и содержание кислорода падает до более низких уровней, удаление силикатов прекращается [3].
Процесс, в результате которого накапливаются отложения в дельтах, приводит к накоплению также частиц органического вещества. Если в дельте присутствуют большие количества его, скорости потребления кислорода вследствие аэробного процесса потребления органического вещества бактериями могут превысить скорость поступления кислорода. В результате уменьшаются концентрации растворенного кислорода.
Сброс сточных вод из городов часто приводит к низким или нулевым концентрациям растворенного кислорода [3].
2.3. Химия главных ионов в морской воде
Изучив химию среды в дельтах, обратимся теперь к глобальным химическим циклам в открытом океане. Начнем с положения, что химия основных ионов в морской воде отлична от химии поверхностных вод континентов (табл. 2). Существуют три основных свойства, отражающих это отличие [4].
-
Высокая ионная сила морской воды (рис. 5), которая содержит около 35 г · л-1 солей;
-
Химический состав морской воды, с высоким содержанием Na+ и Сl- (табл.2);
-
Удивительно постоянные относительные концентрации основных ионов морской воды во всех океанах Земли.
Последнее свойство хорошо иллюстрируют данные, показывающие, что отношение К+ : Cl--, измеренное в океанических областях от Ледовитого океана до Черного моря, практически неизменно в пределах аналитических ошибок 0,0205 ± 0,0007 [4].
В океанах ионы бикарбоната (НСО3-) и Са2+ включены в биологический круговорот, приводящий к вертикальному градиенту их отношений по сравнению с другими основными ионами. Однако различия в отношениях невелики - менее 1 % для кальция. Существуют также данные, что состав основных ионов в морской воде изменялся лишь незначительно в течение многих миллионов лет, поэтому предполагается, что состав океанов контролируется очень долговременным геохимическим круговоротом [4].
Свидетельства о том, что соленость и ионный состав морской воды оставались примерно постоянными в течение по крайней мере последних 900 миллионов лет, были получены на основе изучения древних отложений морских эвапоритов. Эвапориты - это соли, которые выпали природным путем из испаряющейся морской воды в бассейнах, по большей части отрезанных от открытого океана.
В течение последних 900 миллионов лет морские эвапориты обычно идут в последовательности от секции гипс-ангидрит (CaSO4·2H2O-CaSO4 к галиту (NaCl). Горькие соли (названные так из-за их горького вкуса) выпадают на последних стадиях испарения и имеют варьирующий состав, включая магниевые соли, бромиды, хлорид калия (KCl) и более сложные соли, в зависимости от условий испарения (рис. 13) [4].
Порядок выпавших соединений такой же, какой наблюдается в современных морских звапоритах, и его можно воспроизвести опытным испарением морской воды. Эта последовательность осаждения солей устанавливает пределы возможных изменений в составе главных ионов в морской воде, поскольку изменения вне этих пределов имели бы результатом другие последовательности осаждения [4].
2,5 м
£ 3
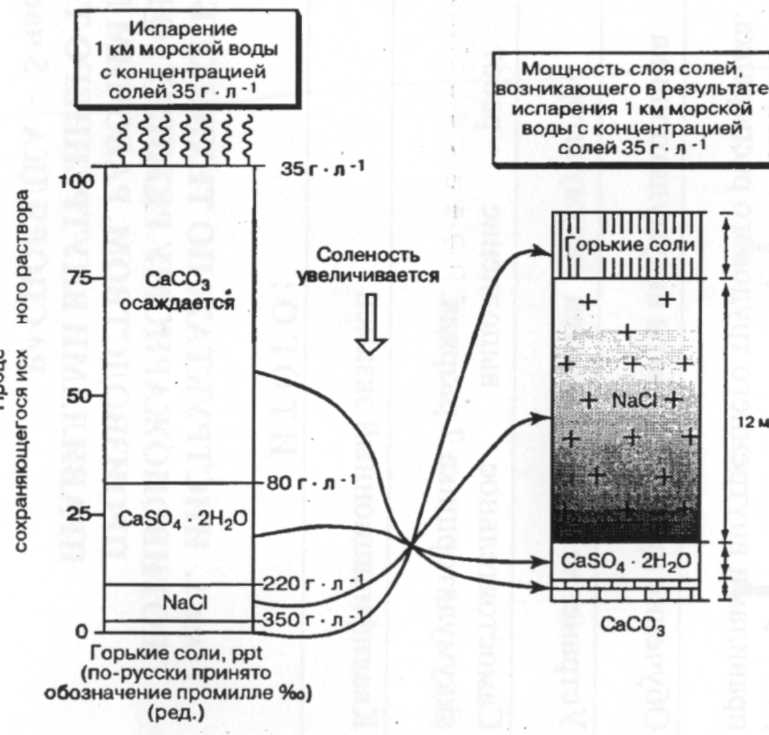
1 и 20 сы
Рис.13. Последовательный ряд и приблизительные мощности слоев солей, осаждающихся при испарении 1 км морской воды
Ряд простых наблюдений дает некоторое представление о возможных изменениях. Например, удвоение концентрации иона кальция (Са2+) при существующей в настоящее время концентрации сульфат-иона (SO42-) не окажет влияния на последовательность осаждения, тогда как утроение концентрации Са2+ уже сделает это. Аналогично, уменьшение или увеличение вдвое существующей в настоящее время концентрации иона калия (К+) повлечет за собой образование некоторых очень необычных горьких солей, не наблюдаемых до сих пор в геологической летописи [3].
Представления об изменениях концентраций иона натрия (Na+) и хлора (Cl-) основаны на ископаемых отложениях галита. Общий объем известных отложений галита достигает около 30% от содержания NaCl в современных океанах. Если всю эту соль добавить в существующие океаны, соленость морской воды увеличилась бы примерно на 30%, что устанавливает верхний предел. Однако основные отложения галита достаточно хорошо распределяются по геологическому времени, и можно предположить, что никогда не было такого периода, чтобы все эти ионы были растворены в морской воде [4].
2.4. Химический круговорот главных ионов
Времена пребывания главных ионов в морской воде являются важным индикатором того пути, по которому происходит химический круговорот в океанах. Все эти времена пребывания очень продолжительны (от 104 до 108 лет) и близки или превышают значения для самой воды (3,8 • 104 лет). Длительные времена пребывания означают, что у океанских течений существует реальная возможность тщательного перемешивания воды и составляющих ее ионов. Это обеспечивает сглаживание изменений в отношениях ионов, возникающих в результате локальных процессов привноса или выноса. Именно большие времена пребывания ионов создают высокое постоянство ионных отношений в морской воде. Времена пребывания являются результатом высокой растворимости ионов и, следовательно, их отношений z/r. Остальные катионы с похожими отношениями также имеют длительные времена пребывания. (например, ион цезия (Cs2+), но они не относятся к главным в морской воде из-за их низкого содержания в земной коре. Интересным исключением является хлор. Его много в морской воде, у него большое время пребывания и тем не менее низкое содержание в земной коре. Большая часть этого С1- дегазировалась из мантии Земли в виде хлористого водорода (НС1) в очень ранний период истории Земли и с тех пор включена в круговорот эвапориты-гидросфера [4].
Более длительные времена пребывания у главных ионов, чем у воды, приводят к тому, что морская вода является более концентрированным раствором, чем речная. Однако различные ионные отношения в морской и речной воде указывают на то, что океаны - это не просто результат наполнения речной водой океанических бассейнов, даже если бы образовавшийся раствор был сконцентрирован путем испарения. Несмотря на то, что у всех главных ионов времена пребывания велики, они различаются более чем на четыре порядка по величине, показывая, что скорости выноса отдельных ионов различны. Поэтому должны действовать процессы, отличные от концентрирования путем испарения [4].
2.4.1. Потоки море - воздух
Потоки море - воздух у главных ионов вызваны разрывами пузырей и ударами волн на поверхности моря. В результате этих процессов морские соли выбрасываются в атмосферу, но основная их часть немедленно падает обратно в море. Некоторые соли, однако, переносятся в атмосфере на большие расстояния и вносят вклад в содержание солей в речной воде. Считается, что эти переносимые по воздуху морские соли имеют такой же относительный ионный состав, что и морская вода. С точки зрения глобальных запасов переносимые по воздуху морские соли являются важным стоком из морской воды только для Na+ и С1- [4].
2.4.2. Эвапориты
Испарение воды способствует осаждению составляющих ее солей, так называемых эвапоритных минералов, в последовательности, которую можно предсказать. Эта последовательность начинается с наименее растворимых солей и заканчивается наиболее растворимыми. Когда испарилась примерно половина (47 %) объема воды, выпадает СаСОз. В процессе последующего испарения и приблизительно четырехкратного увеличения солености выпадает CaSО4 ·2Н2О (гипс):
Са2+(водн)+SO42-(водн)+2Н2О(ж)↔ CaSО4 ·2Н2О(тв) (5)
Когда испарилось около 90% воды (Н2О), при концентрациях растворенных солей около 220 г · л-1, выпадает NaCl:
Na+(водн) + Cl-(водн) ↔ NaCl(тв) (6)
и, кроме того, начинают кристаллизоваться некоторые соли магния (Mg2+); если процессе испарения продолжается, выпадают высокорастворимые соли калия (К+).
Проблема с признанием испарения как процесса удаления ионов из морской воды заключается в том, что в настоящий момент существует очень немного сред, в которых минералы эвапоритов накапливаются в значительных количествах. Причина этого в том, что должны испариться огромные количества морской воды, прежде чем соли сконцентрируются настолько, чтобы начать осаждаться. Ясно, что это не может происходить в хорошо перемешанных открытых океанах, где чистая потеря воды в результате испарения примерно уравновешивается ее поступлением с континентальными поверхностными водами (речным притоком). Это означает, что концентрирование морской воды результате испарения может происходить только в областях аридного климата в бассейнах, большей частью изолированных от открытого океана и других источников поступления воды[4].
2.4.3. Катионный обмен
В процессе катионного обмена на глинистых минералах, перемещающихся из речной воды в морскую, удаляется около 26% от речного притока Na+ в океаны и существенны процессы удаления К+ и Мg2+. Глинистые минералы служат также заметным источником Са2+ в океаны, добавляя лишние 8% к притоку с реками. Однако эти временные значения вдвое больше долговременных величин из-за влияния необычайно высоких скоростей послеледникового привноса взвешенного твердого материала [4].
2.4.4. Осаждение карбонатов
Сложно точно рассчитать, когда морская вода пересыщена или близка к насыщению относительно СаСО3. Существует несколько подходов к решению проблемы, но все они основаны на следующем равновесном отношении, которое описывает осаждение (прямая реакция) или растворение (обратная реакция) СаСО3:
Са2+(водн)+2НСО3-(водн) ↔ СаСО3 (тв) +СО2(г) +Н2О(ж) (7)
Морская вода представляет собой концентрированный и сложный раствор, в котором ионы ближе друг к другу по сравнению с более разбавленными растворами. Между соседними ионами происходят электростатические взаимодействия, что приводит эти ионы в «неактивное» состояние. Мы заинтересованы в доступных или «активных» ионах и делаем поправку на указанный эффект, используя коэффициенты активности [4].
Активная концентрация ионов, или активность, становится важным понятием в концентрированных и сложных растворах типа морской воды. Ионы в концентрированном растворе находятся на достаточно близком расстоянии друг от друга, чтобы между ними происходили электростатические взаимодействия. Эти взаимодействия снижают эффективные концентрации способных участвовать в реакции ионов. Чтобы точно предсказать протекание химических реакций в концентрированных растворах, надо принимать в расчет уменьшение эффективной концентрации, что делается с помощью использования коэффициента активности (у):
Активность = концентрация · у. (8)
Из уравнения (8) видно, что единицы активности и концентрации пропорциональны; другими словами, у можно рассматривать как константу пропорциональности. Такие константы, значение которых изменяется от 0 до 1, можно рассчитать экспериментально или теоретически, и они хорошо известны для некоторых природных растворов. Однако измерение у в сложных растворах типа морской воды оказалось очень трудным. Для наших целей особенно важно, что по мере приближения ионной силы раствора к нулю величина у стремится к 1. Другими словами, в очень разбавленных растворах (например, дождевой воде) активность и концентрация практически равны [4].
Активность выражается в единицах моль • л-1, так же, как и концентрация. Активность обозначается а; результат умножения активностей ионов известен как произведение активностей ионов (ПАИ).
Отметим также, что термодинамические константы равновесия тоже измеряются в единицах активности. Поэтому измеренные концентрации любых химических форм должны быть переведены в активности перед тем, как их сравнивают с термодинамическими данными [4].
Коэффициенты активности крайне трудно измерить в таких сложных растворах, как морская вода, - считается, что они составляют около 0,26 для Са2+ и около 0,20 для карбонат-иона (CO32-). Измеренные концентрации Са2+ и CO32- на поверхности океана равны 0,01 и 0,00029 моль • л-1 соответственно, и таким образом, можно вычислить произведение активностей ионов (ПАИ):
ПАИ = а Са2+∙ а CO32- = 0,01·0,26∙0,00029·0,2 = 1,5∙10-7 моль2 ·л-2 (9)
Это значение намного больше, чем произведение растворимости кальцита (СаСО3), равное 4,5 ∙ 10-9 моль2 • л-2. Степень насыщения равна:
Степень насыщения Ώ = ПАИ/Кsp (10)
Значение Ώ, равное 1, означает насыщение, > 1 - пересыщение и < 1 - недонасыщение. Взяв величины для кальцита, приведенные выше, получим:
Ώ = 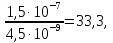
это означает, что морская вода пересыщена в отношении кальцита [4].
В этом подходе не учитываются эффекты образования ионных пар. Из возможности образования ионных пар следует, что около 90% имеющегося в морской воде кальция присутствует в виде свободных ионов, а оставшаяся часть представлена в ионными парами СSO40 и СаНСО3-. Для CO32- вычислено, что только около 10% существует в виде свободных ионов, а остальная часть присутствует в виде ионных пар с Мg2+, Са2+ и Na+. В результате учета этих поправок значение ПАИ уменьшается следующим образом:
ПАИ = 1,5 · 10-7 · 0,9 ∙0,1 = 1,35 ·10-8 моль2 · л-2 (11)
Теперь, вычислив состояние насыщения, имеем:
Ώ = 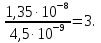
Отсюда следует, что поверхностная морская вода пересыщена в отношении кальцита в три раза. Обобщая, можно заключить, что поверхностная морская вода пересыщена в отношении кальцита, и можно ожидать спонтанного осаждения CO32-.
Данные полевых исследований отчасти противоположны предположениям, основанным на химии равновесий. Абиогенное осаждение СаСО3 представляется ограниченным и привязанным к географически и геохимически необычным условиям. Причины того, почему карбонаты неохотно выпадают из морской воды, до сих пор плохо поняты, но, по-видимому, включают в себя ингибирующие эффекты растворенных ионов и соединений. Даже в местах, где предполагается абиогенное выпадение, обычно трудно не принимать в расчет влияние посредничества микроорганизмов в процессе осаждения [3].
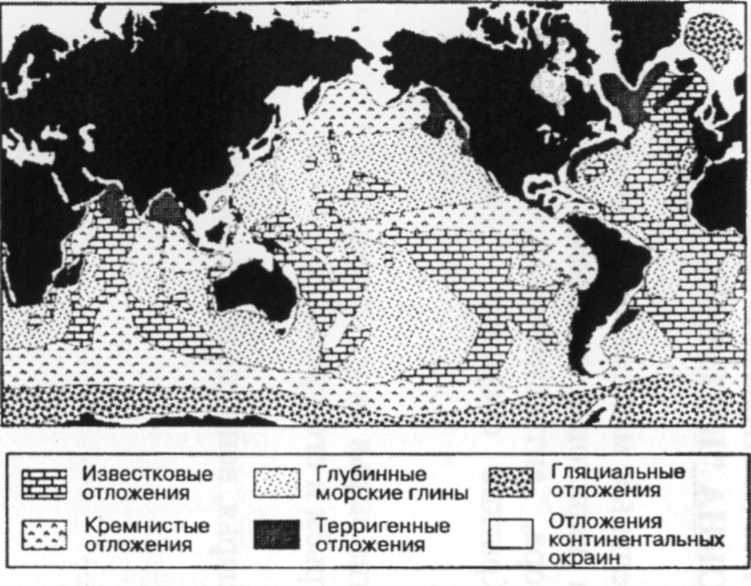 Рис. 14. Современное распределение главных типов морских отложений.
Рис. 14. Современное распределение главных типов морских отложений.
По мощности биологический вынос ионов Са2+ и НСО3-, синтезируемых в скелетах организмов, гораздо более существен. Заманчиво допустить, что такие заметные образования, как большие коралловые рифы тропических и субтропических океанов, и другие «скелетные» карбонаты морских мелководий представляют собой основные участки выноса. В самом деле, вероятно, что большие области континентальных шельфов в современных океанах, образовавшиеся во время поднятия уровня моря в последние 11000 лет, действительно составляют около 45 % глобальных отложений карбонатов. Однако можно показать, что в течение последних 150 миллионов лет скорее отложение карбонатов на глубине океанов было более существенным по объему, составляя между 65 и 80 % глобального поступления карбонатов. Эти глубинные морские отложения, в среднем около 0,5 км по толщине, покрывают примерно половину поверхности глубокого океанического дна (рис. 14). Богатые карбонатами илы состоят из скелетов фитопланктона (кокколитофорид) и зоопланктона (фора-минифер) (рис. 15). Несмотря на то, что эти морские организмы живут в поверхностных водах океанов, после смерти их скелеты опускаются вниз в столбе воды либо сами собой, либо в составе фекальных комочков зоопланктона - пеллетах [4].
 а б
а б
Рис. 15. а - планктонная кокколитофорида Emiliania huxleyi, очень распространенный вид в современных океанах. Этот экземпляр имеет диаметр 8 мкм. Отчетливо видно, что скелет состоит из круглых щитков, окружающих каждую водорослевую клетку. После отмирания кокко-сфера разрушается, щитки (кокколиты) высвобождаются и образуют микроскопические частицы глубинных морских оозов и мела. б - современная планктонная фораминифера Globigerinoides sacculifer, распространенная в тропических океанах.
К факторам, контролирующим распределение морских илов, частично относится доступность питательных веществ, которых должно быть достаточно для поддержания жизни значительных популяций фитопланктона. Однако более важным является растворение СаСОз по мере осаждения частичек в глубинные океанические воды. В глубинных водах океанов концентрации диоксида углерода (СО2) возрастают в результате разложения осажденного органического вещества. Падение температуры и увеличение давления также способствуют растворению СаСО3, благоприятствуя протеканию обратной
реакции в уравнении (7) [4].
Путем картирования глубин существования карбонатных отложений на дне океанов стало возможным определить уровень, на котором скорость поступления биогенного СО32- уравновешивается скоростью его растворения. Эта глубина, известная как глубина компенсации кальцита (ГКК), различается в океанах Земли и зависит от степени недонасыщения СО32- в глубинных водах (рис. 16). В Атлантическом океане ГКК находится на глубине примерно 4,5 км; выше ГКК в Атлантике на глубине примерно 4 км находится критический уровень, называемый лизо-клином (рис. 16). Здесь скорость растворения кальцита заметно увеличивается и все, за исключением наиболее грубых частичек быстро растворяются. По оценкам, около 80% СаСОз, оседающего в глубинные воды, растворяется либо в процессе транспорта через столб воды, либо на морском дне. Вследствие этого отложения морских карбонатов сильнее распространены на более мелких участках глубинного дна океанов (рис. 16) или на топографических высотах, которые проецируются выше ГКК [4].
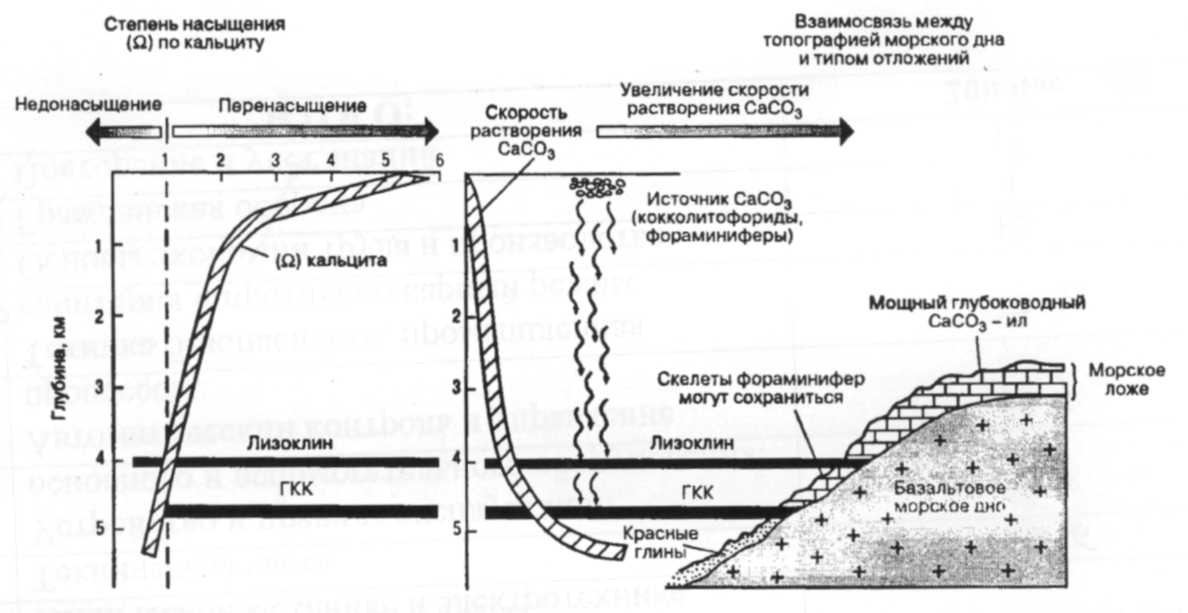 Рис. 4.9. Схематическая диаграмма, показывающая взаимосвязь между степенью насыщения по кальциту в морской воде и скоростью растворения СаСО3 в зависимости от глубины. На глубине 4 км, по мере того как морская вода приближается к недонасыщению по отношению к кальциту, скорость растворения погружающихся известковых скелетов повышается. Такое увеличение скорости растворения маркирует линия лизоклина. Ниже нее растворению не поддаются только крупные частицы (фораминиферы), захороненные в отложениях морского ложа. Ниже глубины компенсации кальцита (ГКК), растворяется весь CaCO3, оставляя глины красного цвета.
Рис. 4.9. Схематическая диаграмма, показывающая взаимосвязь между степенью насыщения по кальциту в морской воде и скоростью растворения СаСО3 в зависимости от глубины. На глубине 4 км, по мере того как морская вода приближается к недонасыщению по отношению к кальциту, скорость растворения погружающихся известковых скелетов повышается. Такое увеличение скорости растворения маркирует линия лизоклина. Ниже нее растворению не поддаются только крупные частицы (фораминиферы), захороненные в отложениях морского ложа. Ниже глубины компенсации кальцита (ГКК), растворяется весь CaCO3, оставляя глины красного цвета.
2.4.5. Опаловые силикаты
 Рис. 17. а - кремнистая радиолярия Theocorythium vetulum, ранний Плейстоцен, экваториальная часть Тихого океана. Масштабный отрезок = 75 мкм; б- кремнистая диатомовая водоросль Coscinodiscus radiants, ранний Плейстоцен, экваториальная часть Тихого океана. Масштабный отрезок = 38 мкм.
Рис. 17. а - кремнистая радиолярия Theocorythium vetulum, ранний Плейстоцен, экваториальная часть Тихого океана. Масштабный отрезок = 75 мкм; б- кремнистая диатомовая водоросль Coscinodiscus radiants, ранний Плейстоцен, экваториальная часть Тихого океана. Масштабный отрезок = 38 мкм.
Опаловые силикаты (опал) - это разновидность продуцируемого биологически диоксида кремния (SiO4 • nН2O), выделяемого как скелетный материал морским фитопланктоном (диатомеями) и одной группой морского зоопланктона (радиоляриями) (рис. 17). Богатые опаловыми силикатами (Si04 ∙ nH2O) отложения покрывают около одной трети морского ложа, особенно в областях с высокими скоростями осадконакопления, привязанными к богатым питательными веществами водам восходящих течений, а также полярным морям, особенно вокруг Антарктики (рис. 14). Морская вода недонасыщена в отношении кремния и, по оценкам, 95% опаловых силикатов растворяется по мере погружения вниз по столбу воды или на границе раздела осадок/вода. Таким образом, сохранение опаловых силикатов происходит только там, где
они захораниваются в быстро накапливаемом осадке, ниже поверхности раздела осадок/вода. Последующее растворение опала в осадке приводит к насыщению поровых вод кремнием. Поровые воды не могут быстро перемешиваться с открытыми морскими водами, и насыщение предотвращает дальнейшее растворение опала. Высокие скорости осадконакопления в океанах могут быть вызваны высокими скоростями поступления минералов с континентов, но обычно причиной являются высокие скорости продуцирования их биологическими агентами. В областях с высокой продуктивностью диатомовые водоросли являются распространенным видом фитопланктона, что повышает значение таких областей как стоков для кремния. Биологический вынос кремния (Si) из морской воды рассчитан на основе содержания опала в отложениях и скоростей осадконакопления [3].
2.4.6. Сульфиды
После того как свободный кислород был потреблен, окисление органического вещества протекает с помощью набора микробиологически опосредованных реакций. Несмотря на то, что в морских отложениях небольшие количества нитратов (NO3-), марганца (Мn) и железа (Fe) пригодны как акцепторы электронов, значение их невелико по сравнению с SO42-, которого много в морской воде (табл. 2). При значении рН морской воды около 8 органическое вещество включается сульфатредуцирующими бактериями в обмен веществ [4].
Этот процесс широко распространен в морских отложениях, но особенно важен в осадках на границе континентов, где накопление органического вещества наибольшее. Восстановление сульфатов протекает на такой глубине (изменяющейся от нескольких миллиметров до метров ниже границы раздела осадок/вода), где морской SO42- может быстро диффундировать или накачиваться организмами, обитающими в отложениях. В результате реакции образуется сульфид водорода (HS-), обладающий высокой реакционной способностью, большая часть которого диффундирует вверх и снова окисляется до SO42- кислородсодержащей морской водой на поверхности осадка. Однако около 10% HS- быстро осаждает растворимый Fe (II) в восстанавливающихся осадках, что приводит к накоплению моносульфида железа [4].
С течением времени моносульфиды железа превращаются в пирит (FeS2); процесс превращения изучен плохо, но, по-видимому, включает поступление серы (S) от промежуточных серосодержащих форм (например, полисульфидов, политионатов или тиосульфата), являющихся продуктами и реагентами в цикле востановления серы в микронишах.
Сульфит (SO32-) затем окисляется до SO42-. Осажденный пирит, образующийся как побочный продукт восстановления сульфатов в морских осадках, является главным стоком морского SO42-. Наличие пирита в древних морских отложениях показывает, что восстановление SО42- происходит уже сотни миллионов лет. В масштабе геологического времени вынос SО42- из морской воды в результате образования отложений пирита считается практически равным выносу его в результате осаждения эвапоритов.
В результате восстановления сульфатов образуется также HCO3- и этот анион медленно диффундирует из осадка в морскую воду, составляя около 7% от потока в океаны. Медленная диффузия означает также, что анион может накапливаться до настолько высоких концентраций в поровых водах осадков, что произведение активностей ионов Са2+ (из морской воды) и аниона превышает произведение растворимости СаСО3 [уравнение (10)]. Это приводит к выпадению СаСОз в осадке в виде ксенолитов (конкреций) [4].
2.4.7. Баланс запасов главных ионов морской воды
Запасы главных ионов в морской воде достаточно хорошо сбалансированы (т. е. приход равен расходу) для всех элементов, за исключением К+. Неопределенное количество К+, по-видимому, потребляется в процессе низкотемпературных реакций между базальтом и морской водой в дополнение к ионообменным реакциям, в результате которых может удаляться до 17% от современного потока К+ с реками. Дисбаланс в запасах К+, а также небольшие дисбалансы в запасах других элементов можно свести к нулю с помощью набора реакций, вероятно, протекающих между морской водой и океаническими отложениями [3].
Одна из возможностей - это «обратные реакции выветривания». При обратном выветривании сильно разрушенные глинистые минералы взаимодействуют с катионами, HCO3- и силикатами морской воды с образованием сложных, подобных глинистым минералам, силикатов. Примером реакции, касающейся проблемы К+, может быть следующая:
Разрушенный + К+(водн) + HCO3- (водн) +Н4SiО4(водн) →К + СО2(г) +Н2О(ж) (13)
алюмосиликат(тв) алюмосиликат(тв)
Из этой реакции видно, что обратное выветривание является строго противоположным реакциям выветривания на суше, в процессе которых потребляется СО2 и высвобождается HCO3-.
Другим процессом, который может вносить небольшой вклад в запасы К+, является фиксация К+ на глинистых минералах в результате реакций ионного обмена. В лабораторных экспериментах показано, что разрушенные слюды и иллиты, лишенные своего К+ в процессе выветривания, но сохранившие большую часть заряда слоя, способны необратимо фиксировать К+ из морской воды. Процесс включает в себя замещение гидратированных катионов в межслоевых пространствах дегидратированным К+, приводя к фиксации К+ на тех участках, на которых он расположен в слюдах. В общем, в этом процессе может удаляться около 10 % от речного потока К+ в океаны [3].
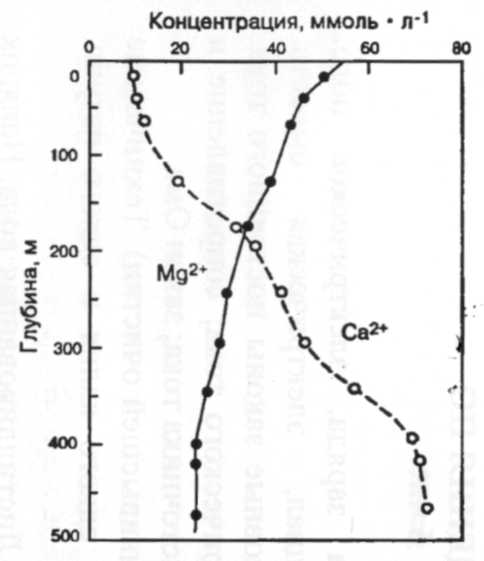 Рис.18. Распределение концентраций растворенных Са2+ и Mg2+ в осадочных поровых водах в зависимости от глубины.
Рис.18. Распределение концентраций растворенных Са2+ и Mg2+ в осадочных поровых водах в зависимости от глубины.
Некоторый вынос ионов из морской воды происходит в результате постоянного захоронения их в поровой воде отложений. Общий вынос главных ионов в этом процессе невелик и составляет менее 2 % от речного привноса для всех элементов, за исключением Na+ и С1-. Вынос в результате захоронения может быть значительным для Na+ и С1- (20-30 % от притока с реками), однако эти данные не точны [34.
Морская вода, захороненная в морских отложениях, может взаимодействовать с их компонентами, особенно с тонкозернистым базальтовым вулканическим пеплом. Концентрации Са2+, Mg2+ и К+ в поровых водах морской коры на большой глубине свидетельствуют о выносе Mg2+ (и в меньшей степени К+) при зеркальном увеличении концентрации Са2+ в поровой воде (рис.18). На основе этих результатов можно предположить, что базальтовый пепел превращается в Mg2+- и К+-содержашие глинистые минералы одновременно с высвобождением Са2+ в поровые воды. Количественная значимость этого механизма в глобальном масштабе, вероятно, мала, однако хорошие данные редки [4].
2.4.8. Антропогенное воздействие на главные ионы
Последним затруднением, связанным с запасами главных ионов в морской воде, является то, что при их оценке рассматривается речной привнос в морскую воду природного происхождения. Антропогенные процессы могут изменять некоторые из этих потоков. Например, в результате человеческой деятельности поток переносимого рекой С1- может увеличиться более чем на 40% , а поток SO42- - удвоиться в основном из-за сжигания ископаемого топлива и окисления H2S, возникшего в результате загрязнения[3].
Человеческая деятельность влияет также на объем твердого стока, переносимого реками. Вырубка лесов и увеличившаяся сельскохозяйственная деятельность по всему миру делают поверхность земли более доступной эрозии. Влияние их на химию главных ионов морской воды заключается в основном в увеличившемся привносе твердого детрита на континентальные шельфы, что приводит к увеличению процессов ионного обмена и других взаимодействий твердое вещество - морская вода. Однако эта ситуация все еще изменчива; увеличение использования речных плотин снижает привнос осадков в океаны в настоящее время. Менее важным со стороны глобальных запасов, но существенным с экологической точки зрения является увеличение количества твердого стока в тропических реках, попадающего с детритом в меловые коралловые рифы береговых вод и приводящее к падению биологической продуктивности в результате снижения чистоты воды [3].
Заключение
Вода в своих трех состояниях - жидкость, лед и водяные пары - широко распространена на поверхности Земли и занимает объем 1,4 млрд. км3. Почти вся эта вода (> 97 %) находится в океанах, а большая часть из оставшейся образует полярные ледяные шапки и ледники (около 2 %). Континентальные пресные воды представляют менее 1 % общего объема, в основном это подземные воды (глубинные - 0,38 %, поверхностные - 0,30 %; озера- 0,01 %, почвенная влага- 0,005 %, реки -0,0001 %, биосфера- 0,00004%). Атмосфера содержит сравнительно мало воды (в виде паров) (0,001 %). В целом эти резервуары воды называют гидросферой [5].
Источник воды при образовании гидросферы неясен. Некоторые метеориты содержат до 20 % воды в связанных гидроксильных (ОН-) группах, в то же время бомбардирование прото-Земли кометами, обогащенными водяными парами, представляет другой возможный источник. Как бы это ни происходило, но когда поверхность Земли остыла до 100°С, водяные пары, дегазирующиеся из мантии, могли сконденсироваться. По существованию погруженных в воду осадочных пород известно, что океаны образовались около 3,8 • 109 лет назад [5].
Очень малое количество водяных паров проникает из атмосферы в космос, поскольку на высоте около 15 км низкие температуры вызывают их конденсацию и выпадание на более низкие уровни. Очень небольшое количество воды дегазируется в настоящее время из мантии. Исходя из этих наблюдений, можно предположить, что после основной фазы дегазации общий объем воды на земной поверхности мало изменялся в течение геологического времени [5].
Круговорот между резервуарами воды в гидросфере называется гидрологическим циклом. Хотя объем водяных паров, содержащихся в атмосфере, мал (около 0,013 · 106 км3), вода постоянно движется через этот резервуар. Она испаряется с поверхности океанов (0,423 ∙ 106 км3/год) и суши (0,073 • 106 км3 год) и переносится с воздушными массами (0,037 • 10б км3/год). Несмотря на короткое время пребывания в атмосфере (обычно 10 дней), среднее расстояние водопереноса составляет около 1000 км. Водяные пары затем возвращаются либо в океаны (0,386 • 106 км3/год), либо на континенты (0,110 • 10б км3/год) в виде снега или дождя. Большая часть дождевых осадков, попадающих на континенты, просачивается через отложения и пористые или раздробленные породы, образуя подземные воды (9,5 · 10б км3); остальная вода течет по поверхности в виде рек (0,13 • 106 км3) или вновь испаряется в атмосферу. Поскольку общее количество воды в гидросфере постоянно во времени, процессы испарения и осаждения должны быть сбалансированы для Земли в целом, несмотря на большие локальные различия между гумидными и аридными регионами [5].
Быстрый перенос воды в атмосфере обусловливается поступающим солнечным излучением. Почти все излучение, достигающее коры, идет на испарение жидкой воды и образование атмосферных водяных паров. Энергия, используемая для этого преобразования, которая затем содержится в парах, называется скрытой теплотой испарения. Большая часть из оставшегося излучения поглощается корой, причем эффективность этого процесса уменьшается с увеличением широты, в основном из-за сферической формы Земли. Солнечные лучи нагревают поверхность Земли под углом 90° на экваторе, но с увеличением широты под все меньшими углами, приближаясь к 0° на полюсах. Таким образом, одинаковое количество излучения распространяется на большие площади в высоких широтах по сравнению с экватором. Изменение с широтой количества поступающего излучения не сбалансировано противоположным явлением излучения с поверхности Земли, таким образом, результатом является общий радиационный дисбаланс. Однако полюса не становятся все более холодными, а экватор - теплее, поскольку тепло перемещается в направлении полюсов с теплыми океаническими течениями, а также существует направленное к полюсам движение теплого воздуха и скрытой теплоты испарения водяных паров [5].
Список использованных источников
-
Эдельштейн, К.К. Гидрология материков: учеб.пособие/К.К. Эдельштейн. - М.: Издательский дом «Академия», 2005. - 304 с. ISBN 5-7695-2176-7
-
Давыдов, Л.К. Общая гидрология:учеб./ Л.К. Давыдов, А.А. Дмитриева, Н.Г. Конкина/под ред. А.Д. Добровольского и М.И. Львовича. - Л.: Гидрометеоиздат, 1993. - 455 с.: ил. ISBN 5-56-075-8
-
Андруз, Дж. Введение в химию окружающей среды: [пер.с англ.]/ Дж.Андруз [и др.]. - М.: Мир, 1999. - 271 с., ил. ISBN 5-03-003289-4
-
Никаноров, А.М. Гидрохимия: учеб./А.М. Никаноров. - Л.: Гидрометеоиздат, 1989. - 348 с.: ил. ISBN 5-286-00138-6
-
Голдовская, Л.Ф. Химия окружающей среды:учеб./Л.Ф. Голдовская. - М.: Мир, 2005. - 296 с.: ил. ISBN 5-03-003649-0
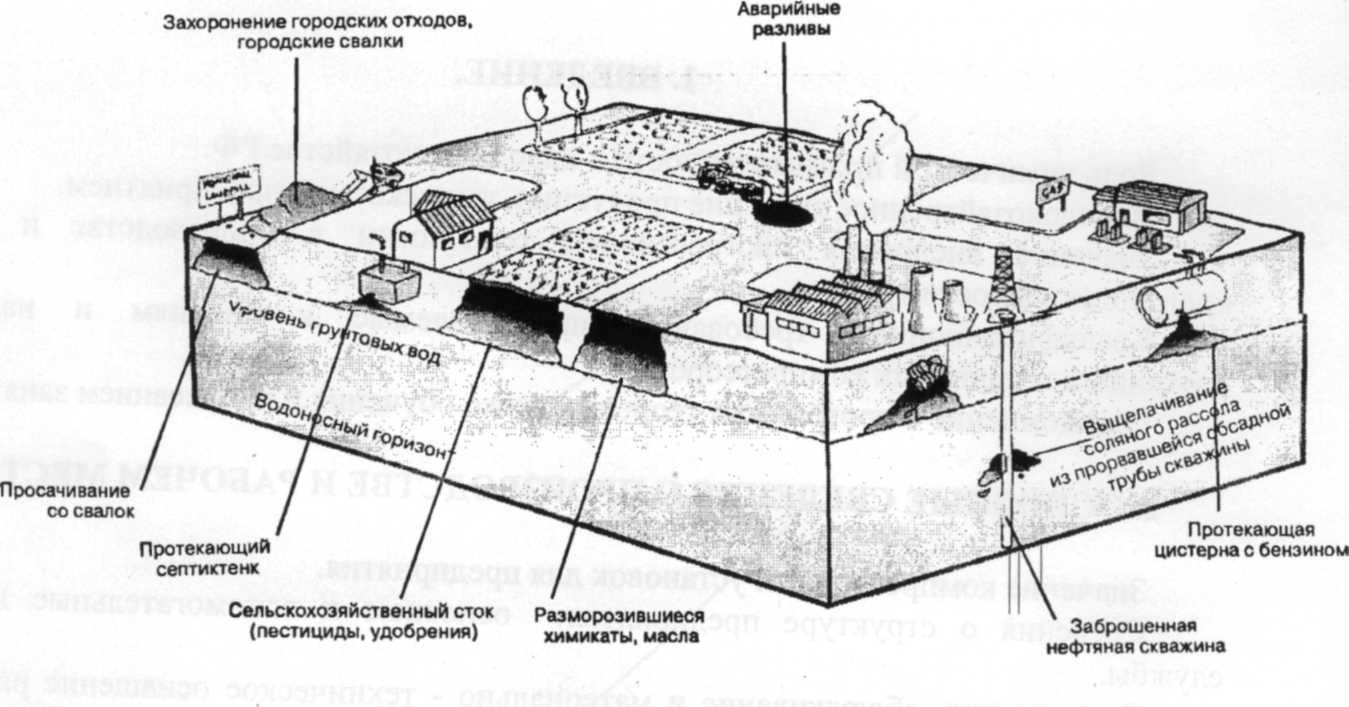 Рис. 9. Типичные механизмы антропогенного загрязнения подземных вод.
Рис. 9. Типичные механизмы антропогенного загрязнения подземных вод.
35


