- Преподавателю
- Другое
- Система заданий по теме Неметаллы, 11 класс для подготовки к ЕГЭ
Система заданий по теме Неметаллы, 11 класс для подготовки к ЕГЭ
| Раздел | Другое |
| Класс | 11 класс |
| Тип | Другие методич. материалы |
| Автор | Пивень О.Ю. |
| Дата | 14.01.2016 |
| Формат | doc |
| Изображения | Есть |
Готовимся к экзаменам
Представленная система заданий по теме «Неметаллы» позволяет углубить и систематизировать знания учащихся по теме, научить их методически правильно и практически эффективно решать задачи. Выполнение данных заданий дает учащимся возможность уточнить собственную готовность и способность осваивать в дальнейшем программу химии на повышенном уровне, возможность реализовать и развить свой интерес в химии.Именно такие задания ожидают абитуриентов на ЕГЭ. Задания охватывают все разделы школьной программы
Углерод и его соединения
Массовая доля кислорода в высшем оксиде элемента ІV группы составляет 72,73%.
-
Определите элемент.
-
Охарактеризуйте положение атома данного элемента в Периодической системе и укажите его количественный состав.
-
Составьте электронную схему строения его атома в нормальном и возбужденном состоянии и укажите возможные степени окисления.
-
Составьте формулы: летучего водородного соединения, оксидов (указав их характер), гидрата, соли данного элемента.
-
Укажите характер химической связи и строение, характерные для соединений данного элемента.
-
Определите массовую долю данного элемента в его гидрате.
-
Определите плотность по водороду высшего оксида данного элемента.
-
Составьте уравнения реакций получения оксидов, летучего водородного соединения данного элемента.
-
Составьте уравнение реакции, подтверждающее наличие высшего оксида данного элемента в воздухе.
-
Определите окислитель и восстановитель в реакции и методом электронного баланса расставьте коэффициенты
C + HNO3(конц) = CO2 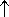 + NO2
+ NO2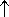 + H2O.
+ H2O.
11. Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде, протекающее при смешивании растворов карбоната натрия и соляной кислоты.
12. Составьте полное молекулярное и ионное уравнение согласно краткому:
Са2+ + СО32- = СаСО3
13. Составьте уравнение гидролиза карбоната калия и укажите характер среды, изменение цвета индикатора в растворе данной соли.
14. Определите массу, объем и количество молекул, содержащихся в 2 моль монооксида данного элемента.
15. Определите объём газа, полученного при взаимодействии 2 моль карбоната калия с соляной кислотой.
16. Определите массу осадка, полученного при пропускании 4,4 г диоксида данного элемента через раствор гидроксида кальция массой 14,8 г.
17. Определите массу соли, полученной при взаимодействии 50 г 18,25% раствора соляной кислоты с карбонатом кальция.
18. Определите объём газа, полученного при прокаливании (нагревание) 200 г известняка, содержащего 10% примесей.
19. Рассчитайте количество теплоты, выделившееся при сгорании 0,25 моль метана, если тепловой эффект реакции - 890 кДж.
20. Вычислите массу металла полученного при электролизе расплава натрий карбоната количеством 2 моль.
21. При прокаливании 50 г кальций карбоната получено 20 г негашеной извести. Вычислите выход продукта от теоретически возможного.
22. Охарактеризуйте аллотропные модификации простого вещества данного элемента в природе.
Сера и ее соединения
При сгорании простого вещества массой 1,6 г получено 3,2 г оксида элемента в степени окисления +4
-
Определите элемент.
-
Охарактеризуйте положение атома данного элемента в Периодической системе и укажите его количественный состав.
-
Составьте электронную схему строения его атома в нормальном и возбужденном состоянии и укажите возможные степени окисления.
-
Составьте формулы: летучего водородного соединения, оксидов (указав их характер), гидрата, соли данного элемента.
-
Укажите характер химической связи и строение, характерные для соединений данного элемента.
-
Определите массовую долю данного элемента в его гидрате.
-
Определите плотность по водороду летучего водородного соединения данного элемента.
-
Составьте уравнения реакций получения оксидов, летучего водородного соединения данного элемента.
-
Составьте уравнение реакции, подтверждающее наличие кислотного остатка (высшая степень окисления элемента) данного элемента в растворе.
-
Допишите уравнение реакции, определите окислитель и восстановитель в реакции и методом электронного баланса расставьте коэффициенты
Na + гидрат высшего оксида (конц.) =
11. Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде, протекающее при смешивании растворов сульфида натрия и соляной (хлоридной) кислоты.
12. Составьте полное молекулярное и ионное уравнение согласно краткому:
Pb2+ + S2- = PbS
13. Составьте уравнение гидролиза сульфита калия и укажите характер среды, изменение цвета индикатора в растворе данной соли.
14. Определите массу, объем и количество молекул, содержащихся в 3 моль диоксида данного элемента.
15. Определите объём газа, полученного при взаимодействии 2 моль сульфита калия с соляной (хлоридной) кислотой.
16. Определите массу осадка, полученного при пропускании 11,2 л диоксида данного элемента через раствор гидроксида натрия массой 40 г.
17. Определите массу соли, полученной при взаимодействии 50 г 49% раствора серной кислоты с гидроксидом натрия.
18. В 100 мл воды растворили 2,24 л сероводорода. Определите процентную и молярную концентрацию полученного раствора.
19. Рассчитайте количество теплоты, выделившееся при сгорании 3,2 серы, если тепловой эффект реакции составляет - 297 кДж.
20. Вычислите объём кислорода полученного при электролизе расплава натрий сульфата массой 14,2 г.
21. Какая соль и в каком количестве образуется при взаимодействии 50 г 4% раствора гидроксида натрия с 50 г 3,4% раствором сероводородной (сульфидной) кислоты.
22. При нейтрализации серной (сульфатной) кислоты раствором гидроксида натрия получено 65 г соли, что составляет 91,55%. Определите массу кислоты вступившей в реакцию.
23. Охарактеризуйте аллотропные модификации простого вещества данного элемента в природе.
Азот и его соединения
Относительная молекулярная масса летучего водородного соединения элемента V группы равна 17.
-
Определите элемент.
-
Охарактеризуйте положение атома данного элемента в Периодической системе и укажите его количественный состав.
-
Составьте электронную схему строения его атома в нормальном и возбужденном состоянии и укажите возможные степени окисления.
-
Составьте формулы: летучего водородного соединения, оксидов (указав их характер), гидрата, соли данного элемента.
-
Укажите характер химической связи и строение, характерные для соединений данного элемента.
-
Определите массовую долю данного элемента в его гидриде.
-
Определите плотность по кислороду летучего водородного соединения данного элемента.
-
Составьте уравнения реакций получения оксидов, летучего водородного соединения данного элемента.
-
Составьте уравнение реакции, подтверждающее наличие кислотного остатка (высшая степень окисления элемента) данного элемента в растворе.
-
Допишите уравнение реакции, определите окислитель и восстановитель в реакции и методом электронного баланса расставьте коэффициенты
Са + гидрат высшего оксида (конц.) =
11. Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде, протекающее при смешивании растворов карбоната натрия и нитратной (азотной) кислоты.
12. Составьте полное молекулярное и ионное уравнение согласно краткому:
NH4+ + OH - = NH3* H2O
13. Составьте уравнение гидролиза нитрата алюминия (1 стадия) и укажите характер среды, изменение цвета индикатора в растворе данной соли.
14. Определите массу и количество молекул, содержащихся в 5,6 л диоксида данного элемента.
15. Определите массу соли, полученной при нейтрализации 2 моль гидрата высшего оксида данного элемента раствором гидроксида натрия.
16. Определите количество осадка, полученного при смешивании растворов содержащих 16,4 г ортофосфата натрия и 34 г нитрата серебра.
17. Определите массу соли, полученной при взаимодействии 100 мл 1М раствора нитратной (азотной) кислоты с гидроксидом кальция.
18. К 50 мл 0,5М раствора нитратной (азотной) кислоты прилили 100 мл воды. Определите процентную и молярную концентрацию полученного раствора.
19. Рассчитайте тепловой эффект горения аммиака, если при сгорании 5,6 л аммиака выделилось 79,155 кДж теплоты.
20. Вычислите объём кислорода полученного при электролизе раствора натрий нитрата, содержащего 42, 5 г соли.
21. Какая соль и в каком количестве образуется при взаимодействии 5,6 л аммиака с серной кислотой количеством 2 моль.
22. При взаимодействии аммиака массой 34г с соляной (хлоридной) кислотой, образовалось 1,5 моль соли. Определите выход продукта реакции от теоретически возможного.
23. Составьте уравнения реакций согласно схемы:
Азот - аммиак - оксид азота (ІІ) - оксид азота (ІV) - азотная кислота - нитрат натрия
Кремний и его соединения
Атом неизвестного элемента имеет конфигурацию наружного энергетического уровня …3S23P2
1. Определите элемент.
-
Охарактеризуйте положение атома данного элемента в Периодической системе и укажите его количественный состав.
-
Составьте электронную схему строения его атома в нормальном и возбужденном состоянии и укажите возможные степени окисления.
-
Составьте формулы: летучего водородного соединения, оксидов (указав их характер), гидрата, соли данного элемента.
-
Укажите характер химической связи и строение, характерные для соединений данного элемента.
-
Определите массовую долю Гидрогена в его летучем водородном соединении.
-
Определите относительную плотность по воздуху летучего водородного соединения данного элемента.
-
Составьте уравнения реакций получения оксида, гидрата данного элемента.
-
Составьте уравнение реакции, подтверждающее наличие кислотного остатка (высшая степень окисления элемента) данного элемента в растворе.
-
Определите окислитель и восстановитель в реакции и методом электронного баланса расставьте коэффициенты
Ca3(PO4)2 + C + SiO2 = CaSiO3 + CO + P
11. Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде, протекающее при смешивании растворов cиликата калия и хлоридной (соляной) кислоты.
12. Составьте уравнения реакций согласно схемы: кремний- оксид кремния (IV)- силикат натрия - силикатная кислота - оксид кремния (IV).
13. Составьте уравнение гидролиза силиката натрия и укажите характер среды, изменение цвета индикатора в растворе данной соли.
14. Определите массу кремния, содержащегося в 120 г его оксида.
15. Определите массу кремния, полученного при восстановлении углём 40 г оксида кремния (IV), содержащего 10% примесей. (Ответ: 16,8 г)
16. Определите количество осадка, полученного при смешивании растворов содержащих 122г силиката натрия и 36,5 г соляной кислоты.
17. К 100г раствора, содержащего 10% натрий силиката досыпали 0,1 моль данной соли. Определите процентную (W%) концентрацию полученного раствора.
18. Вычислите объем воздуха, содержащего 20% кислорода, необходимого для сгорания 0,5 моль кремния.
19. Вычислите количество оксида кремния (IV), полученного при электролизе расплава натрий силиката массой 12,2 г.
20. При разложении 39 г силикатной кислоты образовалось 25 г оксида кремния (IV). Определите выход продукта реакции от теоретически возможного.
Фосфор и его соединения
У атома неизвестного элемента на 5 электронов больше чем у иона алюминия.
1. Определите элемент.
-
Охарактеризуйте положение атома данного элемента в Периодической системе и укажите его количественный состав.
-
Составьте электронную схему строения его атома в нормальном и возбужденном состоянии и укажите возможные степени окисления.
-
Составьте формулы: летучего водородного соединения, оксидов (указав их характер), гидрата, соли данного элемента.
-
Укажите характер химической связи и строение, характерные для соединений данного элемента.
-
Определите массовую долю данного элемента в его высшем оксиде.
-
Определите плотность по азоту летучего водородного соединения данного элемента.
-
Составьте уравнения реакций получения оксидов, летучего водородного соединения данного элемента.
-
Составьте уравнение реакции, подтверждающее наличие кислотного остатка (высшая степень окисления элемента) данного элемента в растворе.
-
Определите окислитель и восстановитель в реакции и методом электронного баланса расставьте коэффициенты
Р + НNO3 + H2O = H3PO4 + NO
11. Составьте уравнение реакции в молекулярном, полном ионном и сокращенном ионном виде, протекающее при смешивании растворов ортофосфорной кислоты и нитрата серебра.
12. Составьте полное молекулярное и ионное уравнение согласно краткому:
3Ag+ + PO43- = Ag3PO4
13. Составьте уравнение гидролиза ортофосфата натрия и укажите характер среды, изменение цвета индикатора в растворе данной соли.
14. Определите массу и количество молекул, содержащихся в 2,24 л летучего водородного соединения данного элемента.
15. Определите количество соли, полученной при нейтрализации 0,5 моль гидрата высшего оксида данного элемента раствором гидроксида натрия.
16. Определите количество осадка, полученного при смешивании растворов содержащих 0,5 моль ортофосфата натрия и 0,5 моль нитрата серебра. (Ответ: 0,17 моль)
17. Какая масса раствора с массовой долей серной (сульфатной) кислоты 70% потребуется для получения фосфорной кислоты из фосфорита массой 200 кг, содержащего 70% ортофосфата кальция. (Ответ: 189,7 кг)
18. Из 100 мл 1М раствора натрий ортофосфата выпарили 20 мл воды. Определите процентную и молярную концентрацию полученного раствора.
19. Вычислите объем воздуха, содержащего 20% кислорода, необходимого для сгорания 2 моль фосфора.
20. Вычислите объём кислорода полученного при электролизе расплава натрий ортофосфата, содержащего 16,4 г соли.
21. Какая соль и в каком количестве образуется при взаимодействии 20 г натрий гидроксида и 49 г ортофосфорной кислоты.
22. При растворении в воде оксида фосфора (V) образовалось 19 г ортофосфорной кислоты, что составляет 96,94% от теоретически возможного выхода. Определите массу оксида фосфора (V), вступившего в реакцию. (Ответ: 14,2 г)
23. Установите формулу кристаллогидрата ортофосфата натрия, содержащего 56,8% воды.
24. Составьте схему получения кальций ортофосфата используя: оксид фосфора (V), фосфор, ортофосфорную кислоту, летучее водородное соединение фосфора.
25. Опишите аллотропные модификации фосфора.


