- Преподавателю
- Другое
- Урок по физике по теме Газовые законы. Изопроцессы в газах
Урок по физике по теме Газовые законы. Изопроцессы в газах
| Раздел | Другое |
| Класс | - |
| Тип | Конспекты |
| Автор | Самойлова С.А. |
| Дата | 05.02.2015 |
| Формат | doc |
| Изображения | Есть |
Урок № 76
по теме «Газовые законы. Изопроцессы в газах». 10 класс.
Дидактические цели:
- Ввести понятие изопроцесса;
- Изучить газовые законы;
- Научиться применять газовые законы;
- Решать количественные и качественные задачи по данной теме.
Задачи урока:
Образовательные:
- Изучить изопроцессы ( истории открытия, зависимости между макроскопическими параметрами, графики изопроцесса, объяснение с точки
зрения МКТ).
- Научить решать аналитические и графические задачи, используя уравнение
состояния и газовые законы.
Ход урока:
-
Актуализация опорных знаний:
Есть у нас идеальный газ
И мы запомним сразу
Закон, который Клапейрон
Открыл для этих газов.
Слева в нем произведенье
Из объема и давления.
Справа R на Т стоит
Запиши закона вид.
-Какие макроскопические параметры связывают уравнение Клапейрона - Менделеева?
-Какие параметры необходимо знать для определения состояния идеального газа? Проводится самостоятельная работа по вариантам.
Вариант 1.
-
Как изменится давление идеального газа при уменьшении его объема в 4 раза и увеличении абсолютной температуры в 2 раза?
А. Увеличится в 8 раз. Б. Увеличится в 4 раза. В Увеличится в 2 раза. Г. Не изменится.
2. Вычислите давление кислорода массой 0,032 кг в сосуде объемом 8,3 м при температуре 100С.
А. 10 Па. Б. 830 Па. В. 100 Па. Г. 373 Па.
3. Как меняется масса воздуха в помещении, если температура увеличивается?
А. Уменьшается. Б. Увеличивается. В . Не изменяется.
4. Чему равен объем 1 моля идеального газа при нормальных условиях?
А.1 м . Б. 24 м . В. 0,024 м.
5.Масса кислорода m при давлении p занимает объем v. Как изменится температура газа, если при увеличении давления до 2p его объем уменьшился в v/10?
А. Увеличится в 5 раз. Б. Уменьшится в 5 раз. В. Не изменится.
Вариант 2.
-
Как изменится давление идеального одноатомного газа при увеличении его объема и температуры в 2 раза?
А. Увеличится в 4 раза. Б. Уменьшится в 2 раза. В. Останется прежним.
-
Вычислите давление водорода массой 0,02 кг в сосуде объемом 8,3 м при
температуре 100С?
А. 3730 Па. Б. 373Па. В. 1000 Па.
3. Чему равны давление и температура газа при нормальных условиях?
А. 10 Па, 100С. Б. 10 Па , 273 К. В. 10 кПа, 273К.
4. При нормальных условиях плотность кислорода:
А. Больше плотности водорода. Б. Меньше плотности водорода.
В. Равна плотности водорода.
5. В баллоне при неизменной массе газа температура увеличилась от 1 до 2С.
Как при этом изменилось давление?
А.Увеличилось в 2 раза. Б. Увеличилось в 1,004 раза. В. Не изменилось.
2. Изучение нового материала:
Если одновременно меняются все характеристики состояния газа, то трудно установит какие либо закономерности. Прошу изучить процессы, в которых масса
И один из трех параметров - p , v или Т остаются неизменными.
Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами.
Первый газовый закон был открыт английским ученым Р. Бойлем (1627-1691гг.) в 1600 г. Работа называлась «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал изменение давления газа в зависимости от объема при постоянной температуре. Данный процесс называется изотермическим.
Независимо от Бойля несколько позднее французский ученый Э. Мариотт пришел к тем же выводам. Поэтому закон получил название Бойля - Мариотта.
PV=const.
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным.
В 1787 году этот закон экспериментально получил французский ученый Жак Шарль.
При v= const давление данной массы газа при постоянном объеме зависит от температуры по закону
p/T= const
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным.
Закон был открыт в 1802 г. французским ученым Жозефом Луи Гей - Люссаком.
Объем данной массы газа при постоянном давлении зависит по линейному закону
V=v(1+ ) v/T= const.
Изотермический процесс
(процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре)
![]()
![]()
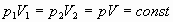
сформулируем определение. (учащиеся формулируют самостоятельно)
определение: для газа данной массы произведение давления на объем постоянна, если температура газа не меняется.- закон Бойля - Мариотта.
![]() - изотерма, изображает обратно пропорциональную зависимость, график находится в первой четверти т.к. величины p,V положительны.
- изотерма, изображает обратно пропорциональную зависимость, график находится в первой четверти т.к. величины p,V положительны.
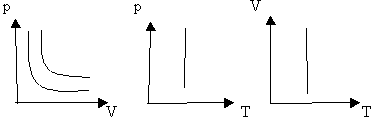
Рис 1.
Вывод: (учащиеся самостоятельно по первому рисунку)
изотерма соответствующая более высокой температуре 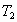 , лежит на графике выше изотермы, соответствующей более низкой температуре
, лежит на графике выше изотермы, соответствующей более низкой температуре ![]() . Построим графики в координатах PT, VT.
. Построим графики в координатах PT, VT.
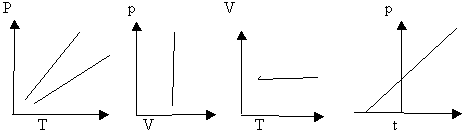
Изобарный процесс.
(процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении).
![]()
![]()
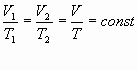
сформулируем определение.
Определение: для газа данной массы отношение объема к температуре постоянно, если давление не изменяется.
![]() прямолинейная зависимость.- закон Гей-Люссака (1802г)
прямолинейная зависимость.- закон Гей-Люссака (1802г)
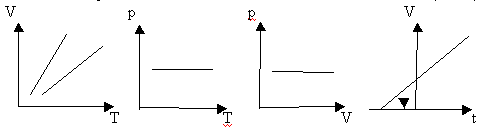
Рис. 2
Вывод: (самостоятельно по рисунку 2)
изобара соответствующая более высокому давлению 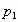 лежит на графике ниже изобары соответствующей более низкому давлению
лежит на графике ниже изобары соответствующей более низкому давлению ![]() . Построим графики в координатах PT, PV,Vt.
. Построим графики в координатах PT, PV,Vt.
Изохорный процесс
(процесс изменения состояния термодинамической системы при постоянном объеме). [1]
![]()
![]()
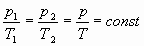
сформулируем определение.
Определение: при данной массе газа отношение давление газа к температуре постоянно, если объем газа не изменяется.- закон Шарля (1787г.)
![]()
Вывод: изохора соответствующая большему объему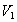 лежит ниже изохоры, соответствующей меньшему объему
лежит ниже изохоры, соответствующей меньшему объему 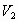 . Построим графики в координатах PV, VT, Pt.
. Построим графики в координатах PV, VT, Pt.
Дополнительный материал.
Рассмотрим работу газовых законов в природе и медицине.
Начнем с того, что закон Бойля - Мариотта начинает «работать на человека» с момента его рождения, с первого самостоятельного вздоха. При дыхании межреберные мышцы и диафрагма периодически изменяют объем грудной клетки. Когда грудная клетка расширяется, давление воздуха в легких падает ниже атмосферного, т.е. «срабатывает» изотермический закон, и вследствии образовавшегося перепада давлений происходит вздох. Другими словами, воздух идет из окружающей среды самотеком до тех пор, пока величины давления в легких и в окружающей среде не выравняются. Важную роль в этом процессе играет плевральная полость, в которой при дыхании возникают разрежения. Если хирургическим путем открыть наружному воздуху доступ в плевральное пространство, то атмосферное давление сожмет легкое, выключив его из процесса дыхания. Именно так делают при лечении легочного туберкулеза.
Существует понятие « физические легкие». Это не биологический орган. А физическая система, которая функционирует подобно биологическим легким. Благодаря «физическим легким» дышит водяной паук серебрянка. Его тело покрыто мелким несмачиваемым пушком. Когда паук погружается в воду, к телу пристают мельчайшие пузырьки воздуха, покрывая его сплошной воздушной оболочкой. В воде эта оболочка блестит ,делая паука похожем на шарик ртути. Выставляя Ий воды кончик брюшка, паук забирает крупный пузырек воздуха и , придерживая его задними ножками, отправляется на глубину. Среди водных растений он натягивает нити своей паутины, «клетку» для воздушного шарика, который все больше и больше наполняется воздухом по мере совершения пауком очередных рейсов на поверхность. Когда воздушный домик становится достаточно просторным, паук переходит к отдыху. Он дышит воздухом своего же домика, хотя принесенного запаса кислорода в нем даже отдыхающему пауку должно было хватать всего на несколько минут. Отдыхать пауку позволяют физические законы.
Дело в том, что в воде вокруг домика - пузырька также имеется воздух. Правда, в растворенном виде. По мере расходования кислорода в пузырьке уменьшается его парциальное давление по сравнению с давлением в воде, и растворенный в воде кислород диффундирует в пузырек. Углекислый же газ, наоборот, диффундирует из домика в воду, где его парциальное давление меньше. Конечно, этот газообмен не позволяет полностью компенсировать затраты кислорода на дыхание, но тем не менее паук получает возможность обновлять атмосферу значительно реже, минут через 309, а то и более.
3. Итог урока, домашнее задание.


