- Преподавателю
- Другое
- Разработка урока по химии «Альдегиды»
Разработка урока по химии «Альдегиды»
| Раздел | Другое |
| Класс | - |
| Тип | |
| Автор | #ЗНАЧ! |
| Дата | 27.12.2012 |
| Формат | docx |
| Изображения | Есть |










 Тема урока: Альдегиды
Тема урока: Альдегиды
Цели урока: Рассмотреть строение альдегидов, их номенклатуру и виды изомерии.
Изучить строение карбонильной группы. Познакомить с физическими свойствами. Углубить знания о взаимном влиянии атомов, генетической взаимосвязи между органическими соединениями. Показать зависимость химических свойств от наличия функциональной группы. Рассмотреть способы получения альдегидов.
Развивать внимание, память, логическое мышление, формировать умения сравнивать, делать выводы. Воспитывать дисциплинированность и самостоятельность в процессе усвоения знаний, ответственность за результаты труда.
Развивать интерес к предмету, творческие способности, внимание, аналитические навыки самооценки своих знаний.
Оборудование и реактивы: Раздаточный материал «Дерево решений», тесты, учебная и
справочная литература, интерактивная доска, ацетальдегид, аммиачный раствор оксида серебра, штатив, спиртовка, пробирки.
Ход урока
I. Организационный момент
II. Подготовка к восприятию нового материала
Сегодняшний урок хотелось бы начать с исторической справки, которая связана с темой урока
Историческая справка
В конце XVIII в. химики интенсивно изучали свойства известных органических соединений. В 1782 г. Карл Шееле, окисляя этиловый спирт оксидом марганца (IV) в серной кислоте, заметил, что помимо основного продукта - уксусной кислоты - образовалось еще какое-то резко пахнущее соединение, выделить которое не удалось (слайд № 1).
В 1821 г. Иоганн Вольфганг Дёберейнер окислял этиловый спирт в присутствии платинового катализатора и получил некоторое количество смеси исходного спирта с продуктами его окисления (слайд № 2). Дёберейнер отправил полученный им образец Ю. Либиху, из которого тот в 1835 г. выделил чистое вещество, содержащее на два атома водорода меньше, чем этанол. Ученый установил его состав (С2Н4О) и объявил, что получил новое вещество, названное Alkohol dehydrogenatus - безводородный алкоголь или сокращенно альдегид (слайд № 3).
Поскольку первый из известных альдегидов содержал два атома углерода, начались попытки получения первого представителя гомологического ряда. Они были неудачными вплоть до 1868 г., когда немецкий химик-органик Август Вильгельм Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О (слайд № 4).
И мы при изучении химических свойств спиртов, говорили, что первичные спирты окисляются до альдегидов, а вторичные спирты до кетонов. То есть образуются новые вещества, с которыми пока еще не знакомы. Давайте вспомним эти реакции.
В качестве окислителей может быть и хромовая смесь, и оксид меди(II). Вспомним химическую реакцию - окисление первичных спиртов оксидом меди (II). В результате данной реакции оксид меди (II) черного цвета восстанавливается до красной металлической меди и образуется альдегид с резким запахом:
СН3-СН2-ОН+ CuO →CH3-C=O +Н2О+ Cu
этанол │
H этаналь (уксусный альдегид) (слайд № 5)
При окислении вторичных спиртов образуются кетоны.
СН3--СН-СН3---------- СН3--С-СН3+ Н2О
│ ║
ОН О
изопропиловый спирт ацетон (пропанон) (слайд № 6)
Вопрос группе:
Сравните исходные и полученные вещества по составу. Есть ли различия? (слайд № 7)
-ОН - гидроксильная группа
-С=О - карбонильная группа
У альдегидов карбонильная группа соединена с атомом водорода и углеводородным радикалом, а у кетонов карбонильная группа соединена с двумя углеводородными радикалами.
Исходя из этого можно сделать вывод, какие вещества называют альдегидами и кетонами.
Органические вещества, в молекулах которых карбонильная группа соединена с атомом водорода и углеводородным радикалом, называют АЛЬДЕГИДАМИ или (алканали) (слайд № 8).
Органические вещества, в молекулах которых карбонильная группа соединена с двумя углеводородными радикалами, называют КЕТОНАМИ (слайд № 9).
III. Изучение нового материала
Это и есть тема сегодняшнего урока: «Альдегиды и кетоны» (слайд № 10)
После объявления темы урока и записи ее в тетради, учитель объявляет этап урока «Ожидание» (высвечивается на интерактивной доске) (слайд № 11)
«Ожидание»- учитель предлагает учащимся сформулировать свои ожидания от заявленной темы, тем самым определятся цели урока. Учащиеся должны высказать свои предложения по поводу того, что они хотят узнать по данной теме. Высказывания записываются на доске. После чего вся информация обобщается и озвучиваются цели урока (выводятся на интерактивную доску)
Цели урока: (слайд № 11)
-
познакомиться со строением альдегидов и кетонов
-
знать физические свойства альдегидов
-
уметь давать названия по систематической номенклатуре
-
зависимость химических свойств от состава и строения
-
применение и получение
Чтобы найти ответы на поставленные вопросы, учебная группа делится на 5 экипажей, которые выбирают направление, по которому будут работать и делать записи в «дереве решений» (лист ватмана) (слайд № 12)
-
Классификация альдегидов, физические свойства альдегидов, строение карбонильной группы
-
Гомологический ряд альдегидов, номенклатура, изомерия, общая формула альдегидов
-
Получение альдегидов
-
Применение формальдегида и ацетальдегида
-
Кетоны, строение, номенклатура, свойства
Учащиеся работают самостоятельно со справочной и учебной литературой, заполняют «дерево решений». После чего представитель каждого экипажа представит информацию для всей группы. Для лучшей работы учитель раздает каждому экипажу перечень вопросов, которые должны быть освещены в «дереве решений».
-
Экипаж
-
Какие альдегиды могут быть в зависимости от природы радикала?
-
Агрегатное состояние альдегидов, запах, растворимость в воде и органических растворителях.
-
Какое явление гибридизации характерно для атома углерода в карбонильной группе?
-
Какой валентный угол между связями в карбонильной группе?
-
-
Экипаж
-
Составьте гомологический ряд первых пяти альдегидов, используя и международное название и тривиальное.
-
Выведите общую формулу альдегидов
-
Какие виды изомерии характерны для альдегидов?
-
От куда начинают нумерацию цепи, чтобы назвать альдегид? (Приведите пример)
-
Экипаж
-
Обратите внимание на промышленный и лабораторный способы получения альдегидов
-
Запишите реакции получения метаналя, этаналя окислением углеводородов кислородом воздуха.
-
Запишите реакцию получения альдегидов окислением первичных спиртов.
-
Запишите реакцию получения альдегидов дегидрированием спиртов (отщеплением водорода)
-
Запишите реакцию получения альдегидов по реакции Кучерова -гидратацией ацетилена и его гомологов (присоединение воды).
-
Экипаж
-
Где содержатся альдегиды?
-
Найдите применение метаналя.
-
Что такое формалин и где он применяется?
-
Найдите применение этаналя.
-
Экипаж
-
-
-
Напишите общую формулу для кетонов и формулу ацетона.
-
Охарактеризуйте физические свойства ацетона
-
Как дают название кетонам?
-
Применение ацетона.
-
-
Информация по основным этапам урока:
Выступление 1 экипажа--Классификация альдегидов, физические свойства альдегидов,
строение карбонильной группы
В зависимости от природы радикала альдегиды делятся на насыщенные, ненасыщенные, ароматические (схема №1) (слайд № 13)
Муравьиный альдегид- первый представитель альдегидов- газ, обладает острым удушливым запахом, хорошо растворяется в воде, 40%-ный водный раствор формальдегида носит название формалина. Температура кипения -21,0◦ С.
Уксусный альдегид - легкокипящая жидкость, с резким удушливым запахом, хорошо растворяется в воде. Температура кипения 20,2◦ С.
Высшие члены гомологического ряда - твердые вещества. С увеличение молекулярной массы температуры кипения и плавления увеличиваются. Первые члены ряда хорошо растворяются в воде. А в органических растворителях растворяются все остальные альдегиды.
Для характеристики физических и химических свойств альдегидов необходимо знать их электронное строение. Атом углерода в карбонильной группе находится в состоянии sp2 - гибридизации. Атомы, связанные с ним лежат в одной плоскости и углы между связями составляют 120 ◦ . Молекула альдегида, подобно этиленовым углеводородам, имеет плоское строение (на доске проецируется рисунок). Двойная связь в молекуле альдегида сильна полярна, так как атом кислорода более электроотрицателен, чем атом углерода. Поэтому электронные пары связи С=О смещаются к атому кислорода. В результате атом кислорода приобретает частичный отрицательный заряд, а атом углерода - частичный отрицательный заряд
Выступление 2 экипажа----Гомологический ряд альдегидов, номенклатура,
изомерия, общая формула альдегидов
По систематической номенклатуре названия альдегидов происходят от названия предельного углеводорода с добавлением суффикса -аль. Тривиальное название обычно связывают с названиями кислот, в которые они переходят при окислении (слайд № 13).
НСОН метаналь (муравьиный, формальдегид)
СН3СОН этаналь (уксусный, ацетальдегид)
СН3СН2СОН пропаналь (пропионовый )
СН3СН2СН2СОН бутаналь (масляный)
СН3СН2СН2СН2СОН пентаналь (валериановый)
СН3СН2СН2СН2СН2СОН гексаналь
СН3 (СН2)5СОН гептаналь
СН3 (СН2)6СОН октаналь
СН3 (СН2)7СОН нонаналь
СН3 (СН2)8СОН деканаль
Исходя из гомологического ряда можно вывести общую формулу альдегидов
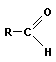 или СnH2nO
или СnH2nO
Изомерия (слайд № 14) Для альдегидов характерен только один вид структурной изомерии - изомерия углеродного скелета, которая возможна с бутаналя .
изомерия углеродного скелета, начиная с С4
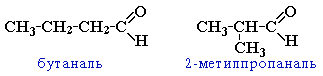
межклассовая изомерия с кетонами, начиная с С3
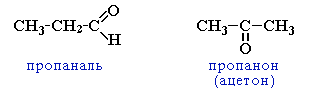
Нумерацию цепи начинают от углеродного атома альдегидной группы, далее записываются номера атомов углерода, с которыми связаны радикалы, потом записывают название соответствующего альдегида ( слайд № 16,17).
СН3
4 3 2 1 │
А) СН3--СН2-- СН --СОН Б) СН3--СН2-- СН2-- С- СН --СОН
│ │
СН3 СН3
2-метилбутаналь 3,3- диметилгексаналь
В) СН3-СН-СН-СОН Г) СН3-СН2-СН--СН---СН-СОН
│ │ │ │ │
СН3 СН3 СН3 СН3 СН3
2,3-диметилбутаналь 2,3,4- триметилгексаналь
Д) СН3 Е) СН3
│ │
СН3-СН2-С--СН2-СОН СН3-СН2-СН--СН-СН-СОН
│ │ │
С2Н5 С2Н5 С2Н5
3-метил-3-этилпентаналь 2-метил-3,4-диэтилгексаналь
Задание для самостоятельной работы учащихся - дайте названия следующим альдегидам по систематической номенклатуре (слайд № 18)
А) СН3-СН2- СН ---С=О Б) СН3-СН2- С=О
│ │ │
СН3 Н Н
В) СН3 Г) СН3 СН3
│ │ │
СН3-СН2 -С-- СОН СН3-С ---С---С=О
│ │ │ │
СН2-СН3 СН3 Н Н
Д) СН3 --(СН2)7--СОН Е) СН3-СН2--СН2--СН-СН2-СОН
│
СН2-СН3
Химические свойства альдегидов (объясняет учитель) (слайд № 19)
Химические свойства альдегидов обусловлены наличием альдегидной группы. Благодаря активности группы СОН альдегиды являются реакционноспособными соединениями
1. Реакция гидрирования - присоединение водорода (слайд № 20).
За счет разрыва π-связи карбонильной группы возможны реакции присоединения, например водорода
а) НСОН + Н2 →СН3ОН
метаналь метанол
б) СН3--С=О + Н2→ СН3--СН2- ОН
│ этанол
Н
этаналь
При нагревании и в присутствии никелевого катализатора в результате образуются соответствующие первичные спирты. Мы обратную реакцию писали в начале урока.
2. Реакции окисления идут по связи С--Н (слайд № 21).
Даже слабые окислители окисляют альдегиды в органические кислоты. Наиболее характерны две реакции, которые применяются для обнаружения альдегидной группы.
а) реакция «серебряного зеркала» - взаимодействие с аммиачным раствором оксида серебра. Если к раствору формальдегида прилить немного аммиачного раствора оксида серебра, то при слабом нагревании образуется блестящий налет серебра (демонстрация опыта, можно показать ролик на интерактивной доске).
НСОН + Аg2O → НСООН + 2 Аg↓
муравьиный муравьиная
альдегид кислота
В этой окислительно-восстановительной реакции формальдегид окисляется в кислоту (муравьиную), а оксид серебра восстанавливается в серебро.
б) реакция с гидроксидом меди (II). (слайд № 22)
Если к раствору формальдегида прилить немного свежеполученного гидроксида меди (II) Cu(OH)2 и нагреть, то в начале образуется желтый осадок гидроксида меди (I) CuOH, который затем превращается в красный осадок оксида меди Cu2O
НСОН + 2Cu(OH)2→ НСООН+ 2 CuOH + Н2О
муравьиный муравьиная желтый
альдегид кислота ↓
Cu2O+ Н2О
красный
В этой окислительно-восстановительной реакции гидроксида меди (II) Cu(OH)2 окисляет альдегид в кислоту, а сам восстанавливается до оксида меди(I) (демонстрация реакции или на экране интерактивной доски).
3.Реакция полимеризации (слайд № 23).
Формальдегид легко полимеризуется, эта реакция имеет важное промышленное значение
О
3 СНОН-------------→
СН2 СН2
О О
СН2
триоксиметилен
nСН2О → (-СН2-О-)n
пароформ
4. Реакция поликонденсации - при взаимодействии формальдегида с фенолом образуется выокомолекулярное соединение - фенолформальдегидная смола, которая используется для получения фенолформальдегидных пластмасс. (слайд № 24)
ОН СН2 ОН СН2 ОН
║ ║
Н + О + Н Н + О + Н Н + …→
фенол формаль
дегид
ОН ОН ОН
-- СН2-- --СН2-- -- СН2
+ Н2О
фенолформальдегидная смола
5. Горение альдегидов (слайд № 25).
2CH3CHO + 5O2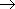 4CO2 + 4H2O
4CO2 + 4H2O
этаналь
6. Реакция замещения. Для альдегидов характерна реакция по углеводородному радикалу. Галоген замещает атом водорода в радикале (слайд № 26).
СН3-СОН + Cl2→ ClСН2-СОН+НCl
Выступление 3 экипажа
Получение альдегидов
1. В промышленности альдегиды получают окислением углеводородов кислородом воздуха. Например, окислением метана получают метаналь, окислением этилена - этаналь (слайд № 27)
-
CH4 + O2
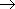 H-C=O + H2O (При 500oС в присутствии оксидов азота)
H-C=O + H2O (При 500oС в присутствии оксидов азота)
метан │
Н
метаналь
-
2C2H4 + O2
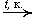 2CH3CHO
2CH3CHO
этилен этаналь
2 . Из темы «Химические свойства спиртов», мы помним, что окислением первичных спиртов получают альдегиды. (слайд № 28)
1. СН3-СН2-СН2ОН [ О]→ СН3-СН2-С=О + Н2О
пропанол-1 │
Н
пропаналь
2. CH3OH + CuO 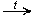 HCHO + Cu + H2O
HCHO + Cu + H2O
метанол метаналь
Интересная справка! (слайд № 29)
При употреблении алкогольных напитков большую опасность, чем этанол, представляет уксусный альдегид, который образуется при окислении этого спирта.
Уксусный альдегид в 30 раз токсичнее спирта. Он вызывает изменения коры головного мозга, на уровне ДНК. Это приводит к возникновению мутаций и различным видам уродств у эмбрионов, а так же появлению генов алкоголизма психических заболеваний.
-
Дегидрирование спиртов (отщеплением водорода) можно получить альдегид (слайд № 30)
CH3-CH2-OH ![]() CH3CHO + H2
CH3CHO + H2
этанол этаналь
Справка! Название «альдегид» происходит от «дегидрирование алкоголя».
-
Альдегиды получают по реакции Кучерова гидратацией ацетилена и его гомологов (присоединение воды). Эта реакция была проведена Кучеровым в 1881 году. У реакции есть недостаток - соединения ртути, которые используются в качестве катализатора, могут вызвать отравления. Это лабораторный способ получения альдегидов(слайды № 31,32)
С2Н2 + Н2О → СН3-С=О
ацетилен │
Н
Этаналь
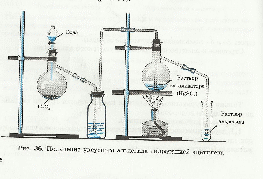
Выступление 4 экипажа - Применение формальдегида и ацетальдегида (слайд № 33)
Альдегиды в нашей жизни.
Булочки ванильные, корицы аромат,
Амаретто, шоколад
Альдегидов вкус тая
В землянике и кокосе
И в жасмине и в малине
И в духах и в еде
Альдегидов след везде.
Что за запах, что за прелесть,
И откуда эта свежесть?
Это высший альдегид
Аромат вам свой дарит.
Отличительной чертой многих альдегидов является их запах. Высшие альдегиды, особенно непредельные и ароматические, входят в состав эфирных масел и содержатся в цветах, фруктах, плодах, душистых и пряных растениях. Их используют в пищевой промышленности и парфюмерии.
Так называемая "альдегидная нота" очень часто присутствует в женской и мужской парфюмерии. Альдегиды - это химические вещества, в чистом виде напоминающие запах прогорклого сливочного масла, но стоит их разбавить, как они начинают звучать по-иному, приобретая легкий аромат цветочной свежести. Удивительная черта альдегидов - подстраиваться под естественный запах кожи, усиливая ведущие ноты всей парфюмерной композиции. Запах альдегидов чем-то напоминает шипр или пудру, запах только что задутой свечи.
Первый "синтетический аромат", изготовленный на основе альдегидов - легендарный Chanel № 5, созданный Эрнестом Бо. Мадемуазель Шанель увидела в лице эмигранта из России свой будущий триумф в парфюмерии: и не ошиблась. Несколько лет спустя мир получил шедевр - изысканные и легкие цветочные духи под номером 5. Парфюмеры всех стран были очарованы, и в активе специалистов появилась новая группа ингредиентов "альдегиды".
С тех пор сложные химические соединения стали использоваться при создании множества разнообразных духов - терпких и легких, сладких и цветочных.Раньше альдегиды использовались преимущественно в создании женских духов, позже они проникли и в мужскую парфюмерию.
Например, анисовый кетон - это запах аниса и фенхеля;
камфара - запах сосны, пихты и розмарина;
карвон - запах тмина и майорана.
коричный альдегид отвечает за запах корицы и гвоздики;
бензальдегид - жасмина, роз и розового дерева.
циветон обусловливает запах ирисов и вербены;
фурфурол - запах базилика и свежего хлеба.
Насекомые общаются между собой, выделяя небольшое количество органических веществ, относящихся к классам альдегидов и кетонов. Эти вещества называют феромонами. Синтетические феромоны используются для борьбы с вредными насекомыми путем заманивания их в ловушки, дезориентации в период спаривания, отпугивания.
Ванилин С8Н8О3. (слайд № 37) В плодах ванили содержится ароматический альдегид, который придает им характерный запах. По запаху ванилин можно обнаружить в чрезвычайно малых количествах, однако повышение его концентрации не усиливает эффект. Ванилин применяется в парфюмерии, кондитерской промышленности, для маскирования запахов некоторых продуктов.
Цитраль. (слайд № 38) 3,7-диметил-2,6-октадиеналь (запах лимона) Запах цитрусовых обусловлен данным диеновым альдегидом. Его применяют в качестве отдушки средств бытовой химии, косметических и парфюмерных веществ.
Коричный альдегид С9Н8О. (слайд № 39) Коричный альдегид содержится в масле корицы, его получают перегонкой коры дерева корицы. Применяется в кулинарии в виде палочек или порошка. Корица известна не только благодаря запаху, но и при лечении метеоризма
Наибольшее применение находят муравьиный и уксусный альдегиды. (слайд № 34, 35)
Большое количество метаналя используется для получения фенолформальдегидной смолы. Эта смола необходима для производства различных пластмасс, из которых изготавливаются: а) электротехнические изделия; б) детали машин и др.
При растворении фенолформальдегидной смолы в ацетоне или спирте получают различные лаки.
Метаналь идет также на производство некоторых лекарственных веществ и красителей. Широко применяется водный раствор, содержащий в массовых долях 0,4 или 40% метаналя. Он называется формалином. Его использование основано на свойстве свертывать белок. Так, например, в кожевенном производстве дубящее действие формалина объясняется свертыванием белка, в результате чего кожа твердеет и не подвергается гниению. На этом же свойстве основано применение формалина для сохранения биологических препаратов. Формалин - прозрачная бесцветная жидкость со своеобразным острым запахом. Применяют как дезинфицирующее и дезодорирующее средство для мытья рук, обмывания кожи при повышенной потливости (мазь формальдегидная- применяют при повышенной потливости, втирают в подмышечные впадины, в межпальцевые складки), для дезинфекции инструментов (0,5 %), для спринцеваний (1:2000 - 1:3000). Входит в состав лизоформа. (лизоформ - мыльный раствор формальдегида. Оказывает дезинфицирующее и дезодорирующее действие. Применяют в гинекологической практике, для дезинфекции рук). Иногда формалин используется для протравливания семян. При взаимодействии формальдегида с аммиаком получается широко известное лекарственное вещество уротропин.
Этаналь в основном идет на производство уксусной
кислоты. Восстановлением ацетальдегида в некоторых странах получают этиловый спирт
Выступление 5 экипажа---кетоны, строение, номенклатура, свойства
Кетоны - органические вещества, у которых карбонильная группа С=О соединена с углеводородными радикалами.
Общая формула кетонов 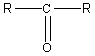
У кетонов группу С=О называют еще кетогруппой.
Для кетонов характерна изомерия углеродного скелета и изомерия положения карбонильной группы. Кроме этого, для них характерна межклассовая изомерия. Общая формула для таких изомеров СпН2пО.
Изомерия кетонов: углеродного скелета (c C5)
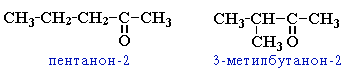
положения карбонильной группы (c C5)
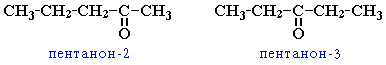
Систематические названия кетонов несложного строения производят от названий радикалов (в порядке увеличения) с добавлением слова кетон.
Например:
А) CH3-C-CH3 - диметилкетон (ацетон) Б) CH3--CH2-CH2-C-CH3 - метилпропилкетон
║ ║
О О
В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе.
Например:
А) CH3-CO-CH3 пропанон (ацетон);
Б) CH3CH2CH2-CO-CH3 - пентанон-2;
В) CH2=CH-CH2-CO-CH3 - пентен-4-он-2.
Ацетон - бесцветная жидкость, с водой смешивается в любых соотношениях. Широко используется в качестве растворителя, в органическом синтезе из него получают изопрен, ацетатное волокно и др. его используют для растворения нитроцеллюлозы, ацетилцеллюлозы.
Получают кетоны окислением вторичных спиртов
СН3--СН-СН3---------- СН3--С-СН3+ Н2О
│ ║
ОН О
изопропиловый спирт ацетон (пропанон)
Вывод:
Человек не знакомый с органической химией и в частности со свойствами, особенностями, применением альдегидов и кетонов может быть поражен насколько наша жизнь зависит от группы этих веществ.
Благодаря тому, что получение альдегидов и кетонов возможно различными простыми и доступными способами, мы не испытываем недостатка во многих предметах необходимых для нашего существования. Альдегиды необходимы для получения пластмасс, лаков, лекарственных веществ, красителей, уксусной кислоты. Так же они находят применение в медицине и электротехнике, парфюмерии и кулинарии.
IV. Закрепление
-
Фронтальный опрос
Какие вещества называют альдегидами?
Какие вещества называют кетонами?
Назовите общую формулу альдегидов и кетонов
Назовите агрегатное состояние формальдегида
Назовите агрегатное состояние ацетальдегида
Что такое формалин?
Назовите качественные реакции на альдегиды
Перечислите области применения формальдегида
-
Тестовый контроль (тест проводится в программе Microsoft Offise Power Point. Тест состоит из двух этапов. Сначала обучающий тест, затем контролирующий, в котором те же вопросы, но уже выставляется оценка )
1 вопрос - Общая формула альдегидов
А) СnH2n+1O В) СnH2n-1O
Б) СnH2nO Г) СnH2nOn-4
2 вопрос - Ацетальдегиду соответствует формула
А) СН3СОН В) СН3 (СН2)7СОН
Б) НСОН Г) С2H5OН
3 вопрос - Каково правильное название альдегида
СН3-СН - СОН
│
СН3
А) 3-метилбутеналь В) 2 -пропилбутеналь
Б) 2-метилпропаналь Г) 2-метилбутеналь
4 вопрос - Органические вещества, в молекулах которых карбонильная группа соединена с атомом водорода и углеводородным радикалом, называют
А) фенолами В) альдегидами
Б) спиртами Г) кетонами
5 вопрос - Группа 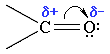 называется
называется
А) карбоксильная В) гидроксильная
Б) карбонильная Г) карбоновая
6 вопрос - Атом углерода в карбонильной группе находится в состоянии
А) Sp3 - гибридизации Б) Sp - гибридизации В) Sp2 - гибридизации
7 вопрос - Агрегатное состояние уксусного альдегида
А) Кристаллическое вещество В) Легкокипящая жидкость,
с резким удушливым запахом
Б) Газ с острым удушливым запахом Г) Твердое вещество
8 вопрос - При реакции гидрирования альдегидов образуются
А) карбоновые кислоты В) кетоны
Б) спирты Г) фенолы
9 вопрос - Реакция «серебряного зеркала» - это взаимодействие альдегидов с
А) гидроксидом меди (II) В) водородом
Б) фенолом Г) аммиачным раствором оксида серебра
10 вопрос - 40% раствор метаналя называют
А) кетон В) ванилин
Б) бензальдегид Г) формалин
3. Решение задач
1. Вычислите массовую долю углерода в молекуле муравьиного альдегида.
Решение: 100% х%
НСОН--- С Ответ: ω (С) 40%
30г 12г
-
Вычислите массовую долю водорода в молекуле пропаналя.
Решение: 100% х%
СН3СН2СОН ----6Н Ответ: ω (Н) 10,3%
58 г 6 г
-
Вычислите массу ацетальдегида (г), который был получен при гидратации ацетилена объемом 112 л, если выход реакции составляет 75%
Решение: 112 л х г 75%
С2Н2+Н2О → СН3СОН 1) 112 л х г Х= 220 г.
22,4 44 22,4 44 г
2) 220 г - 100% х = 165 г
Х г 75% Ответ: 165 г.
-
Вычислите массу ацетилена (г), которая потребуется для получения 748 г ацетальдегида, если выход продукта составляет 85%
Решение: х г 748 г 85%
С2Н2+Н2О → СН3СОН 1) 748 г 85% Х= 880г.
26 г 44 г Х г 100%
2) х г - 880 г х= 520 г
26 г 44 г Ответ: 520 г ацетилена
-
Вычислите массу этилового спирта (г), которая образуется в результате гидрирования 66 г ацетальдегида.
Решение: 66 г х г
СН3--СОН + Н2→ СН3--СН2- ОН
44 г 46 г Ответ: 69г V. Домашнее задание
Глава 9 § 9.1 стр. 183
§ 9.2 стр. 187 Упр. № 10 стр. 192 по учебнику Темирбулатова А. «Химия, 11»
Используемая литература
-
А. Темирбулатов «Химия, 11», издательство Алматы «Мектеп», 2007
-
И.Н. Чертков «Химия. Органическая химия», издательство Алматы «Просвещение - Казапхстан», 2007
-
Б.А. Мансуров «Сборник тестовых заданий по органической химии, 10-11», издательство Алматы «Атамура», 2004
-
Интернет-ресурсы
Алгоритм названия альдегидов
-
Пронумеровать самую длинную углеродную цепь, начиная с атома углерода в карбонильной группе.
-
Указать положение радикала и его название.
-
Назвать углеводород, то есть пронумерованную цепь.
-
Принадлежность к классу альдегиды указать с помощью суффикса аль.
Алгоритм названия кетонов
-
Пронумеровать самую длинную углеродную цепь, начиная с того конца цепи, где ближе карбонильная группа.
-
Указать положение радикала и его название.
-
Назвать углеводород, то есть пронумерованную цепь.
-
Принадлежность к классу кетоны указать с помощью суффикса он.
-
Указать положение функциональной группы.


