- Преподавателю
- Биология
- Разработка факультативного курса по разделу: Белки Нуклеиновые кислоты
Разработка факультативного курса по разделу: Белки Нуклеиновые кислоты
| Раздел | Биология |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Каримходжаева Д.Н. |
| Дата | 12.02.2015 |
| Формат | doc |
| Изображения | Есть |
Разработка факультативного курса
по разделу: Белки Нуклеиновые кислоты
для учащихся 10 класса средней школы.
Разработала
учитель биологии
Сарыбашской ОШ
I-III ступеней
Каримходжаева Д.Н
2013
Оглавление.
Введение…………………………………………………………..3
Раздел 1 Литературный обзор …………………………………..
1.1 Факультативные занятия …………………………………....5
1.2 Цель и принципы факультативных занятий ……………….. Методические рекомендации по изучению факультативного курса по теме: «Белки»…………………………………….9
4.Методические рекомендации по изучению факультативного курса по теме «Нуклеиновые кислоты»……………26
5.Список литературы………………………………..48
Введение
В обмене веществ организма ведущая роль принадлежит белкам и нуклеиновым кислотам. Белковые вещества составляют основу всех жизненно важных структур клетки, они входят в состав цитоплазмы. Белки обладают необычайно высокой
реакционной способностью. Они наделены каталитическими функциями, т.е. являются ферментами, поэтому белки определяют направление, скорость и теснейшую
согласованность, сопряженность всех реакций обмена веществ.
Ведущая роль белков в явлениях жизни связана с богатством и разнообразием их химических функций, с исключительной способностью к различным превращениям и взаимодействиям с другими простыми и сложными веществами, входящими в состав
цитоплазмы. Нуклеиновые кислоты входят в состав важнейшего органа клетки - ядра, а также цитоплазмы, рибосом, митохондрий и т.д. Нуклеиновые кислоты играют важную, первостепенную роль в наследственности, изменчивости организма, в синтезе
белка. (8.10)
Одной из задач современной биологии и ее новейших разделов - молекулярной биологии, биоорганической химии, физико-химической биологии - является расшифровка механизмов синтеза молекулы белка, содержащей сотни, а иногда и тысячи остатков аминокислот.
Цель курса факультатива заключается в том, чтобы помочь учащимся разобраться в наиболее сложных для понимания вопросах биологии, испытать себя в решении тестовых заданий и наилучшим образом подготовиться к единому государственному экзамену и централизованному тестированию. (15.6)
Задачей факультатива является:
краткое изложение основ биологии, повторение всего объемного теоретического материала, дающего представление об этой науке;
приобретение навыка в решении тестовых заданий;
на примере выполнения творческих заданий изучение дополнительной литературы, с целью приобретения знаний выходящих за пределы базового уровня требований к подготовке выпускника.
В настоящее время вышло и выходит в свет большое количество разнообразных учебников и пособий, в которых рассматриваются теоретические вопросы. Безусловно, для того, чтобы качественно подготовиться и продемонстрировать отличные и хорошие знания любого предмета, необходимо много работать над учебной и дополнительной литературой.
Цель данной работы : разработать некоторые методические рекомендациик изучению темы : «Молекулярная биология»для учеников 10 класса Сарыбашской Общеобразовательной школы , для более эффективного усвоения учебного материала при изучении данной темы. В связи с этим для реализации намеченной цели определены следующие задачи:
1. Изучить по литературным источникам опыт учителей, пути и методы активизации познавательной деятельности учащихся.
2. Разработать практическую методику изучения темы «Белки их структура и биологические функции» с включением опорных конспектов.
Раздел 1. Методический обзор.
Факультативные занятия - форма организаций учебных занятий в школе во внеурочное время, направленное на расширение, углубление и коррекцию знаний учащихся по учебным предметам в соответствии с их потребностями, запросами, способностями и склонностями, а также на активацию познавательной деятельности
Организационная структура - это совокупность индивидуальных и коллективных субъектов, между которыми распределены полномочия и ответственность за организацию, и проведение факультативных занятий
Факультативные занятия, второй вид групповых занятий, также строятся на добровольной основе. Они отличаются от юннатских кружков тем, что проводить их надо с небольшими группами (не более 10-15 человек) учащихся по особым более усложненным, углубленным и расширенным программам Министерства образования или по программам, составленным руководителем (учителем или специалистом) факультатива. Цель факультативной подготовки - дать учащимся знания и практические умения по различным разделам биологической, сельскохозяйственной, методической, педагогической науки в объеме, значительно превышающем школьную программу. Она имеет также большое значение для профессиональной ориентации учащихся, т.к. на факультативные занятия записываются только те, кто собирается работать в сельском хозяйстве или продолжать образование в специальных учебных заведениях (сельскохозяйственных, педагогических, биологических, медицинских и т.д.). Другими словами, наиболее целесообразны сейчас факультативы профилей: биологический, педагогический, агрономический (полеводы, овощеводы, садоводы, пчеловоды, механизаторы, фермеры, предприниматели, менеджеры, животноводы), медицинский, экологический..(15)
Посещение занятий для записавшихся учащихся обязательны. Они проводятся по твердому расписанию. Весьма целесообразно, чтобы факультативные занятая проводились не только и школьными учителями-предметниками, но и приглашенными учеными вузов.Факультативные занятия накладывают на учителя повышенную ответственность, т.к. тут особо интересующиеся и одаренные учащиеся жаждут получить новое, актуальное, оригинальное знание. Плохо и недопустимо, чтобы факультативы превращались в дополнительные внеурочные занятия, например, по решению задач, примеров, упражнений, подготовке к контрольной работе, зачетам, экзаменам. В отличие от обычных предметных классно-урочных занятий на факультативных должны преобладать более активные формы подготовки: лекции, семинары, деловые и ролевые игры, самостоятельная лабораторная и практическая работа с литературой не только учебной, но и специальной дополнительной, написание и защита рефератов и, наконец, самостоятельное выполнение практической и особенно исследовательской экспериментальной работы. Все это в комплексе способствует развитию и формированию умений самостоятельно и творчески применять полученные на факультативе знания на практике, в жизни. Группа "ассистентов" создается для того, чтобы оборудовать и поддерживать в должном порядке биологический кабинет, живой уголок, пришкольный учебно-опытный участок. Несомненно, они должны выполнять то, что им посильно и органично связано с процессом обучения биологии. В частности, они изготавливают учебные пособия, приборы, инструменты, инвентарь, таблицы. Подготавливают раздаточный материал, помогают учителю в подготовке пособии к уроку, демонстрации их на уроке и уборке. Можно выделить заведующих кабинетом.
1 .2 Цели факультативных занятий:
-повышение качества образования учащихся;
-углубление изучения отдельных предметов;
- подготовка старшеклассников к централизованному тестированию;
-подготовка одаренных детей к олимпиадам;
-формирование профориентационной компетентности учащихся базовой школы;
-общекультурное развитие учеников;
-приобщение учащихся к исследовательской деятельности;
-коррекция пробелов в знаниях и умениях учащихся;
Принципы факультативных занятий.
- соответствие законодательной и информативной базы;
- самоопределения учащихся;
-учета возрастных особенностей, познавательных интересов;
-ресурсной обеспеченности;
-доступности;
-занимательности в организационной факультативных занятий;
По форме на факультативных занятиях как и на уроках применяются индивидуальные парные групповые и коллективные формы работы. Но здесь необходимо широкое применение практических форм работы: тренингов практикумов лабораторных работ исследований экскурсий и т.п.
По продолжительности возможно и целесообразно организовывать факультативы в течении учебного года полугодия четверти. Выбор продолжительности проведения факультатива зависит от темы и содержания интереса учащихся.
Особенности организации образовательного процесса на факультативных занятиях.
Факультативные занятия существенно отличаются от обычных уроков. На факультативах у учащихся больше свободы возможностей для инициативы проявления творчества самостоятельности личностной самореализации. Предполагается высокий уровень самостоятельности учебной деятельности детей высокий уровень обобщения. Отдается предпочтение поисковым методами исследованиям. Организуется интерактивное общение и взаимообучение. Учитель во взаимной деятельности формирует опыт работы с информацией, опыт практического использования знаний. Расширяется опыт познавательной деятельности развития познавательного интереса.
Раздел 2
Занятие №1 Тема. Методические рекомендации по изучению факультативного курса по теме: «Белки
Цель: углубить знания учащихся о строении свойствах функциях аминокислот белков в жизнедеятельности организмов.
Ход урока
I Организационный этап.
II Актуализация опорных знаний и мотивация учебной деятельности.
Вопрос к учащимся:
-Догадайтесь, о каких органических веществах идет речь: «Работа мышц иммунитет, осуществление обмена веществ, ускорение биохимических реакций, восприятие окружающего мира - все это работа этих веществ».Они -основа жизни на Земле.( Белки)
Мотивация
«Жизнь - это способ существования белковых тел» (Ф. Энгельс). (6.16) Есть гипотеза, что первыми микроорганизмами на Земле явились микроорганизмы, попавшие вместе с метеоритами на нашу планету. Ученые также предполагают, что вспышки эпидемий гриппа связаны с падением метеоритов: проходит примерно 10 лет - начинается эпидемия. Эти 10 лет нужны для приспособления «чужих» микроорганизмов к земным условиям. Любой биологический объект, начиная от вирусов и заканчивая человеком, состоит в основном из белков (в пересчете на сухое вещество: ), поэтому очень важно знать строение и свойства этих соединений
III Изучение материала.
План :
1.Исследование и строение белковых молекул.
2.Классификация белков.
3.Функции белков.
Исследование белков
Свое название белки получили от яичного белка, который с незапамятных времен использовался человеком как составная часть пищи. Согласно описаниям Плиния Старшего, уже в Древнем Риме яичный белок применялся и как лечебное средство. Однако подлинная история белковых веществ начинается тогда, когда появляются первые сведения о свойствах белков как химических соединений (свертываемость при нагревании, разложение кислотами и крепкими щелочами и т. п.). Среди белков животного происхождения, вслед за яичным белком, были охарактеризованы белки крови. Образование сгустков крови при ее свертывании описано еще основателем учения о кровообращении У. Гарвеем; позднее на этот факт обратил внимание и Р. Бойль. Среди растительных белков пальма первенства принадлежит нерастворимой в воде клейковине из пшеничной муки, которую впервые получил Я. Беккари. В своих работах, он отметил сходство клейковины с веществами животной природы.
К началу XIX столетия появляются первые работы по химическому изучению белков. Уже в 1803 г. Дж. Дальтон дает первые формулы белков - альбумина и желатина - как веществ, содержащих азот. В 1810 г. Ж. Гей-Люссак проводит химические анализы белков - фибрина крови, казеина и отмечает сходство их элементного состава. Решающее значение для понимания химической природы белков имело выделение при их гидролизе аминокислот. Очень близок к истине был и А. Я. Данилевский, который в своей работе "Исследование состава, физического и химического строения продуктов распадения белковых веществ и генетических отношений между различными их видами" справедливо утверждал, что белки построены из аминокислот и имеют полимерную природу.
А знаете ли вы что:
Молекулы белков состоят из цепочек аминокислот и имеют очень сложную структуру. В молекуле белков может быть от 5 тыс. до 1 млн. аминокислотных остатков. В составе белков встречается 20 аминокислот, в том числе незаменимые.
В организме человека более 5 млн. белков. В клетке 10-20% от сырой массы и 50-80% от сухой массы клетки составляют белки. Без белков невозможно представить движение, способность расти, размножение, сократимость. Они образуют покровные и мышечные ткани, защищают организм от болезней, переносят кислород к клеткам.
Белки по происхождению делятся на животные и растительные, незаменимые аминокислоты содержаться только в животных белках.
Белки играют важную роль в пищевой промышленности. Они способны набухать в воде, образовывать студни, стабилизировать суспензии, эмульсии, пены. Например: качество теста зависит от содержания белка (клейковины) в муке, чем его больше, тем хлеб и хлебобулочные изделия получатся лучше. Благодаря способности белков образовывать пены, мы имеет кондитерские изделия, такие как пастила, суфле, зефир. Процесс тепловой обработки белкового сырья позволяют нам готовить различные вкусные и полезные мясные, рыбные, творожные и другие блюда.
Белковая пища в организме распадается на аминокислоты, часть аминокислот используется для синтеза белков, нужных организму, а оставшаяся часть окисляется до мочевины, углекислого газа и воды.
Вопрос к учащимся:
Назовите уровни организации белковой молекулы? (первичная, вторичная, третичная, четвертичная)
При изучении состава белков было установлено, что все они построены по единому принципу и имеют четыре уровня организации: первичную, вторичную, третичную, а отдельные из них и четвертичную структуры.
1.Первичная структура
Представляет собой линейную цепь аминокислот (полипептид), расположенных в определенной последовательности с четким генетически обусловленным порядком чередования и соединенных между собой пептидными связями. Пептидная связь образуется за счет -карбоксильной группы одной аминокислоты и -аминной группы другой/К настоящему времени установлены последовательности аминокислот для нескольких тысяч различных белков. Запись структуры белков в виде развернутых структурных формул громоздка и не наглядна. Поэтому используется сокращенная форма записи - трехбуквенная или однобуквенная.(6.49)
Вторичной структурой называют конформацию, которую образует полипептидная цепь. Для высокомолекулярных белков характерна структура спирали.
Впервые такая структура на основе рентгеноструктурного анализа была обнаружена при изучении главного белка волос и шерсти -- кератина (Л. Полинг). Ее назвали -структурой или -спиралью. Обычно в природных продуктах встречаются белки со строением правой спирали, хотя известна и структура левой спирали.
Спиральные структуры белка.
Для полипептидных цепей известно несколько различных типов спиралей. Если при наблюдении вдоль оси спирали она удаляется от наблюдателя по часовой стрелке, то спираль считается правой (правозакрученной), а если удаляется против часовой стрелки - левой (левозакрученной). Наиболее распространена правая -спираль (предложена Л. Полингом и Р. Кори). Идеальная -спираль имеет шаг 0,54 нм и число однотипных атомов на один виток спирали 3,6. строение спирали стабилизируется внутримолекулярными водородными связями.
Третичная структура
Сведения о чередовании аминокислотных остатков в полипептидной цепи (первичная структура) и наличие в белковой молекуле спирализованных, слоистых и неупорядоченных ее фрагментов (вторичная структура) еще не дают полного представления ни об объеме, ни о форме, ни тем более о взаимном расположении участков полипептидной цепи по отношению друг к другу. Эти особенности строения белка выясняют при изучении его третичной структуры, под которой понимают - общее расположение в пространстве составляющих молекул одной или нескольких полипептидных цепей, соединенных ковалентными связями. То есть третичная конфигурация - реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль, которая в свою очередь свернута спиралью. У такой структуры в пространстве имеются выступы и впадины с обращенными наружу функциональными группами.
Полное представление о третичной структуре дают координаты всех атомов белка. Благодаря огромным успехом рентгеноструктурного анализа такие данные, за исключением координат атомов водорода получены для значительного числа белков. Это огромные массивы информации, хранящиеся в специальных банках данных на машиночитаемых носителях, и их обработка немыслима без применения быстродействующих компьютеров. Полученные на компьютерах координаты атомов дают полную информацию о геометрии полипептидной цепи, что позволяет выявить спиральную структуру, -складки или нерегулярные фрагменты.
Третичная структура формируется в результате нековалентных взаимодействий (электростатические, ионные, силы Ван-дер-Ваальса и др.) боковых радикалов, обрамляющих -спирали и -складки, и непериодических фрагментов полипептидной цепи. Среди связей, удерживающих третичную структуру, следует отметить:
а) дисульфидный мостик (-S-S-) между двумя остатками цистеина;
б) сложноэфирный мостик (между карбоксильной группой и гидроксильной группой);
в) солевой мостик (между карбоксильной группой и аминогруппой);
г) водородные связи между группами -СО - и -NH-;
Третичной структурой объясняется специфичность белковой молекулы, ее биологическая активность.
Четвертичная структура
У большинства белков пространственная организация заканчивается третичной структурой, но для некоторых белков с молекулярной массой больше 50-100 тысяч, построенных из несколько полипептидных цепей характерна четвертичная.
Сущность такой структуры в объединении несколько полимерных цепей были в единый комплекс. Такой комплекс также рассматривается как белок, состоящий из нескольких субъединиц. Белки, состоящие из нескольких субъединиц, широко распространены в природе (гемоглобин, вирус табачной мозаики, фосфорилаза, РНК-полимераза). Субъединицы принято обозначать греческими буквами (так у гемоглобина имеется по две и субъединицы). Наличие нескольких субъединиц важно в функциональном отношении - оно увеличивает степень насыщения кислородом. Четвертичная структура стабилизируется в основном силами слабых воздействий:
а) водородная; б) гидрофобная; в) ионные; г) ковалентные (дисульфидные, пептидные).
Структурными единицами белков являются б-аминокислоты. В каждом белке присутствует 20 б-аминокислот. Из них может быть образовано 2 432 902 008 176 640 000 комбинаций, т.е. различных белков (сравните: 33 буквы алфавита и количество слов в русском языке).(6.)
Классификация белков.
Все белки принято делить на простые белки, или протеины, и сложные белки, или протеиды (комплексы белков с небелковыми соединениями).Простые белки являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы.
Протеины представляют собой простые белки, состоящие только из остатков аминокислот. Они широко распространены в животном и растительном мире.
Гистоны
Имеют сравнительно низкую молекулярную массу (12-13 тыс.), с преобладанием щелочных свойств. Локализованы в основном в ядрах клеток. Растворимы в слабых кислотах, осаждаются аммиаком и спиртом. Имеют только третичную структуру. В естественных условиях прочно связаны с ДНК и входят в состав нуклеопротеидов. Основная функция - регуляция передачи генетической информации с ДНК и РНК (возможна блокировка передачи).
Протамины
Самая низкая молекулярная масса (до 12 тыс.). Проявляет выраженные основные свойства. Хорошо растворимы в воде и слабых кислотах. Содержатся в половых клетках и составляют основную массу белка хроматина. Как и гистоны образуют комплекс с ДНК, функция - придают ДНК химическую устойчивость.
Глютелины
Растительные белки, содержащиеся в клейковине семян злаковых и некоторых других, в зеленых частях растений. Нерастворимые в воде, растворах солей и этанола, но хорошо растворимы в слабых растворах щелочей. Содержат все незаменимые аминокислоты, являются полноценными продуктами питания.
Проламины
Растительные белки. Содержатся в клейковине злаковых растений. Растворимы только в 70%-м спирте (это объясняется высоким содержанием пролина и неполярных аминокислот).
Протеиноиды
Белки опорных тканей (кость, хрящ, связки, сухожилия, ногти, волосы). Нерастворимые или трудно растворимые в воде, солевых и водно-спиртовых смесях белки с высоким содержанием серы. К протеиноидам относятся кератин, коллаген, фиброин.
Сложные белки делят на ряд классов в зависимости от характера простетической группы.
Фосфопротеины
Имеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Такая локализация фосфопротеидов свидетельствует о важном их значении для развивающегося организма. У взрослых форм эти белки присутствуют в костной и нервной тканях.(6.74)
Липопротеины
Сложные белки, простетическая группа которых образована липидами. По строению это небольшого размера (150-200 нм) сферические частицы, наружная оболочка которых образована белками (что позволяет им передвигаться по крови), а внутренняя часть - липидами и их производными. Основная функция липопротеинов - транспорт по крови липидов. В зависимости от количества белка и липидов, липопротеиды подразделяются на хиломикроны, липопротеиды низкой плотности (ЛПНП) и высокой плотности (ЛПВП), которые иногда обозначаются как - и -липопротеиды.(6.70.)
Металлопротеины
Содержат катионы одного или нескольких металлов. Наиболее часто это - железо, медь, цинк, молибден, реже марганец, никель. Белковый компонент связан с металлом координационной связью.
Гликопротеины
Простетическая группа представлена углеводами и их производными. Исходя из химического строения углеводного компонента, выделяют 2 группы:
Истинные - в качестве углеводного компонента наиболее часто встречаются моносахариды. Протеогликаны - построены из очень большого числа повторяющихся единиц, имеющих дисахаридный характер (гиалуроновая кислота, гипарин, хондроитин, каротинсульфаты).
Функции: структурно-механическую (имеются в коже, хряще, сухожилиях); каталитическую (ферменты); защитную; участие в регуляции клеточного деления. (6.75)
Элементный состав белков
Белки содержат в среднем около 1 6% азота, 50-55% углерода , 21-23% кислорода , 15-17% азота , 6-7% водорода , 0,3-2,5% серы . В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах.
Содержание основных химических элементов в белках может различаться, за исключением азота, концентрация которого характеризуется наибольшим постоянством.
Для идентификации белков и полипептидов используют специфические реакции на белки. Например :
а) ксантопротеиновая реакция ( появление желтого окрашивания при взаимодействии с концентрированной азотной кислотой, которое в присутствии щелочи становиться оранжевым ; реакция связана с нитрованием остатков фенилаланина и тирозина);
Практическая часть
Опыт №1 Ксантопротеиновая реакция.
Цель опыта: Обнаружить в белке ароматические аминокислоты. С помощью этой реакции в белке открывают ароматические аминокислоты- триптофан , фенилаланин и тирозин. Реакция обусловлена нитрованием бензольного кольца концентрированной азотной кислотой и выпадением осадка желтого цвета.
Реактивы и оборудование: раствор разбавленного яичного белка, концентрированная азотная кислота, 10%-ный раствор гидроксида натрия, штатив с пробирками, спиртовка.
Ход опыта: К 5 каплям разбавленного раствора яичного белка добавить 3 капли концентрированной азотной кислоты и осторожно нагреть. Отметить наблюдаемые явления. После охлаждения осторожно (не взбалтывая!) добавить 5-10 капель 10% раствора гидроксида натрия до появления оранжевого окрашивания. (1.13.)
Наблюдаемые изменения записать.
б) биуретовая реакция на пептидные связи - действие разбавленного сульфата меди (II) на слабощелочной раствор белка сопровождающийся появлением фиолетово-синей окраски раствора ,что обусловлено комплексообразованием между медью и полипептидами.
Опыт 2. В чистую пробирку налейте 1 мл раствора сульфата меди, добавьте раствор гидроксида натрия до образования синего осадка. Затем добавьте 1 мл раствора белка. Что наблюдаете? (1.18 )
Денатурация белков
Денатурация белка - разрушение сил (связей), стабилизирующих четвертичную, третичную и вторичную структуры, приводящее к дезориентации конфигурации белковой молекулы и сопровождаемое изменением растворимости, вязкости, химической активности, характера рассеивания рентгеновских лучей, снижением или полной потерей биологической функции.
Различают физические (температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучения) и химические (тяжелые металлы, кислоты, щелочи, органические растворители, алкалоиды) факторы, вызывающие денатурацию.
Практическая часть.
Опыт №3 Осаждение белка при кипячении. (1.20)
Цель опыта: изучить влияние среды и температуры на процесс денатурации белка.
Реактивы и оборудование: 0.5%-ный раствор яичного белка, 1% раствор уксусной кислоты, 10% раствор уксусной кислоты,10 % раствор гидроксида натрия, штатив с пробирками, спиртовка.
Ход работы: В 4 пронумерованные пробирки прилить по 10 капель 0.5 % раствора яичного белка. Затем:
-
1-ю пробирку нагреть до кипения, при этом раствор белка мутнеет, но осадок не выпадает, так как частицы денатурированного белка несут заряд. Это связано с тем, что яичный белок имеет кислые свойства и в нейтральной среде заряжен отрицательно.
-
Во 2-ю пробирку добавить 1 каплю 1% раствора уксусной кислоты и нагреть до кипения. Белок выпадает в осадок, так как его раствор приближается к изоэлектрической точке и белок теряет заряд (один из факторов устойчивости белка в растворе.)
-
В 3-ю пробирку добавить одну каплю 10% раствора уксусной кислоты и нагреть до кипения. Осадка не образуется, так как в сильнокислой среде частицы белка приобретают положительный заряд (сохраняется один из факторов устойчивости белка в растворе).
-
В 4-ю пробирку добавить одну каплю 10 % раствора гидроксида натрия и нагреть до кипения. Осадок не образуется ,поскольку в щелочной среде отрицательный заряд частиц белка увеличивается.
Способность белков реагировать и с кислотами и со щелочами свидетельствует о том, что белки - амфотерные вещества.
Функции белков в организме многообразны. Они являются катализаторами биохимических реакций,
Многочисленные биохимические реакции в живых организмах протекают в мягких условиях при температурах, близких к 40. С, и значениях рН близких к нейтральным. В этих условиях скорости протекания большинства реакций ничтожно малы, поэтому для их приемлемого осуществления необходимы специальные биологические катализаторы - ферменты. Даже такая простая реакция, как дегидратация угольной кислоты:
C
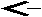 O2 + H2O HCO3-+ H+
O2 + H2O HCO3-+ H+
катализируется ферментом карбоангидразой. Вообще все реакции, за исключением реакции фотолиза воды 2H2O4H+ + 4e- + O2, в живых организмах катализируются ферментами (реакции синтеза, осуществляются при помощи ферментов синтетаз, реакции гидролиза - при помощи гидролаз, окисление - при помощи оксидаз, восстановление с присоединением - при помощи гидрогеназ и т.д.). Как правило, ферменты - это либо белки, либо комплексы белков с каким-либо кофактором - ионом металла или специальной органической молекулой. Ферменты обладают высокой, иногда уникальной, избирательностью действия. Например, ферменты, катализирующие присоединение -аминокислот к соответствующим т-РНК в процессе биосинтеза белка, катализируют присоединение только L-аминокислот и не катализируют присоединение D-аминокислот.
Транспортная функция белков
Внутрь клетки должны поступать многочисленные вещества, обеспечивающие ее строительным материалом и энергией. В то же время все биологические мембраны построены по единому принципу - двойной слой липидов, в который погружены различные белки, причем гидрофильные участки макромолекул сосредоточены на поверхности мембран, а гидрофобные "хвосты" - в толще мембраны. Данная структура непроницаема для таких важных компонентов, как сахара, аминокислоты, ионы щелочных металлов. Их проникновение внутрь клетки осуществляется с помощью специальных транспортных белков, вмонтированных в мембрану клеток. Например, у бактерий имеется специальный белок, обеспечивающий перенос через наружную мембрану молочного сахара - лактозы. Лактоза по международной номенклатуре обозначается -галаткозид, поэтому транспортный белок называют -галактозидпермеазой.
Важным примером транспорта веществ через биологические мембраны против градиента концентрации является К/ Na-ый насос. В ходе его работы происходит перенос трех положительных ионов Na+ из клетки на каждые два положительных иона K+ в клетку. Эта работа сопровождается накоплением электрической разности потенциалов на мембране клетки. При этом расщепляется АТФ, давая энергию. Молекулярная основа натрий-калиевого насоса была открыта недавно, это оказался фермент, расщепляющий АТФ - калий-натрийзависимая АТФ-аза.
У многоклеточных организмов существует система транспорта веществ от одних органов к другим. В первую очередь это гемоглобин. Кроме того, в плазме крови постоянно находится транспортный белок - сывороточный альбумин. Этот белок обладает уникальной способностью образовывать прочный комплексы с жирными кислотами, образующимися при переваривании жиров, с некоторыми гидрофобными аминокислотами со стероидными гормонами, а также со многими лекарственными препаратами, такими, как аспирин, сульфаниламиды, некоторые пенициллины.
Рецепторная функция
Большое значение, в особенности для функционирования многоклеточных организмов, имеют белки-рецепторы, вмонтированные в плазматическую мембрану клеток и служащие для восприятия и преобразования различных сигналов, поступающих в клетку, как от окружающей среды, так и от других клеток. В качестве наиболее исследованных можно привести рецепторы ацетилхолина, находящиеся на мембране клеток в ряде межнейронных контактов, в том числе в коре головного мозга, и у нервно-мышечных соединений. Эти белки специфично взаимодействуют с ацетилхолином CH3C(O) - OCH2CH2N+(CH3)3 и отвечает на это передачей сигнала внутрь клетки. После получения и преобразования сигнала нейромедиатор должен быть удален, чтобы клетка подготовилась к восприятию следующего сигнала. Для этого служит специальный фермент - ацетилхолинэстераза, катализирующая гидролиз ацетилхолина до ацетата и холина.
Многие гормоны не проникают внутрь клеток-мишеней, а связываются со специфическими рецепторами на поверхности этих клеток. Такое связывание является сигналом, запускающим в клетке физиологические процессы.
Защитная функция
Иммунная система обладает способностью отвечать на появление чужеродных частиц выработкой огромного числа лимфоцитов, способных специфически повреждать именно эти частицы, которыми могут быть чужеродные клетки, например патогенные бактерии, раковые клетки, надмолекулярные частицы, такие как вирусы, макромолекулы, включая чужеродные белки. Одна из групп лимфоцитов - В-лимфоциты, вырабатывает особые белки, выделяемые в кровеносную систему, которые узнают чужеродные частицы, образуя при этом высокоспецифичный комплекс на этой стадии уничтожения. Эти белки называются иммуноглобулины. Чужеродные вещества, вызывающие иммунный ответ называют антигенами, а соответствующие к ним иммуноглобулины - антителами.(6.16)
Антитела построены из четырех полипептидных цепей, связанных между собой дисульфидными мостиками.
Структурная функции
Наряду с белками, выполняющими тонкие высокоспециализированные функции, существуют белки, имеющие в основном структурное значение. Они обеспечивают механическую прочность и другие механические свойства отдельных тканей живых организмов. В первую очередь это коллаген - основной белковый компонент внеклеточного матрикса соединительной ткани.
В эластичных тканях - коже, стенках кровеносных сосудов, легких - помимо коллагена внеклеточный матрикс содержит белок эластин, способный довольно в широких пределах растягиваться и возвращаться в исходное состояние.
Еще один пример структурного белка - фиброин шелка, выделяемый гусеницами шелкопряда в период формирования куколки и являющийся основным компонентом шелковых нитей.
Двигательные белки
Мышечное сокращение является процессом, в ходе которого происходит превращение химической энергии, запасенной в виде макроэргических пирофосфатных связей в молекулах АТФ, в механическую работу. Непосредственными участниками процесса сокращения являются два белка - актин и миозин.(6.16)
IV. Закрепление знаний.
1) Что называется белками?
2) Какие вещества являются структурными единицами белков
3) Заполните таблицы:
Виды структуры белков
Название структуры
Что собой представляет
Какими связями поддерживается
1. первичная
линейная цепь
пептидными
2. ……………
……………….
……………….
3. ……………
……………….
……………….
4. ……………
……………….
……………….
4) Функции белков в организме.
Проверка степени усвоения материала
Ответьте на вопросы тестового задания .
1. Какие вещества входят в состав белков?
а) аминокислоты; б) спирты; в) эфиры; г) кислоты
2. Сколько аминокислот участвуют в образовании белков?
а) 16; б) 20; в) 30; г) 10
3. Какие белки называются неполноценными?
а) в которых отсутствуют некоторые аминокислоты;
б) в которых отсутствуют некоторые незаменимые аминокислоты;
в) в которых отсутствуют некоторые заменимые аминокислоты.
4. В результате какой реакции образуются белки?
а) гидролиз; б) поликонденсация; в) гидратация; г) этерификация;
5 Из перечисленных реакций выберите реакции, свойственные белкам
а) гидролиз б) гидратация в) денатурация
г) поликонденсация д) горение е) замещение
7. Какого цвета образуется осадок при взаимодействии белка:
а) с концентрированной азотной кислотой;
б) с гидроксидом меди: а) ……., б)………….
Занятие №2 Тема Методические рекомендации по изучению факультативного курса по теме «Нуклеиновые кислоты». Строение, свойства, функции Нуклеиновых кислот.
Цель: углубить знания учащихся о нуклеиновых кислотах, их строении свойствах, роли в жизнедеятельности организмов; закрепить умение выполнять упражнения по транскрипции и репликации. Провести опыт-эксперимент « Удивительная молекула ДНК»
Задачи:
-раскрыть особенности строения молекулы ДНК.
-изучить физические и химические свойства ДНК
- увидеть ДНК своими глазами!
Ход урока
I Организационный этап.
II Актуализация опорных знаний и мотивация учебной деятельности.
-Составление синквейна.
В переводе с французского слово «синквейн» означает стих , составляющий из пяти строк.
Составление синквейна объединяет информационную, личностно ориентированную систему обучения. Такая форма работы показывает, что ученик знает содержание темы, умеет выделить главное и применить приобретенные знания. Написание синквейна является формой свободного творчества в определенных рамках.
Правила составления синквейна
На первой строке одно слово-существительное (тема).
На второй - два прилагательных (какой? какая? какое?).
На третьей - три глагола (что делает?).
На четвертой - крылатое выражение или фраза в контексте с темой.
На пятой - одно слово, вывод.
Синквейн можно использовать как загадку.
Пример:
ДНК
Длинная, двуспиралевидная
Сохраняет, кодирует, передает
Книга жизни
Матрица
Обсудим вместе.
Древние греки в мифах создавали образ богини, которая пряла нить жизни человека, а современные ученые доказали: «Если молекулы ДНК всех клеток одного человека вытянуть в одну линию, то она будет длиной от Земли до Солнца. Длина одной молекулы ДНК - около четырех метров».
ДНК- «нить жизни».
III Изучение материала
Из истории изучения нуклеиновых кислот.
Открытие нуклеиновых кислот принадлежит швейцарскому химику Ф. Мишеру, который продолжительное время изучал ядра лейкоцитов, входящих в состав гноя. Кропотливая работа замечательного исследователя увенчалась успехом. В 1869 г. Ф. Мишер обнаружил в лейкоцитах новое химическое соединение, которое назвал нуклеином (лат. nucleus - ядро). Дальнейшие исследования показали, что нуклеин представляет собой смесь нуклеиновых кислот. Впоследствии нуклеиновые кислоты были обнаружены во всех растительных и животных клетках, бактериях и вирусах. Однако химическое строение нуклеиновых кислот и их основных компонентов устанавливалось с трудом. В природе существуют два вида нуклеиновых кислот: дезоксирибонуклеиновая и рибонуклеиновая. Различие в названиях объясняется тем, что молекула ДНК содержит сахар дезоксирибозу, а молекула РНК - рибозу
С момента открытия нуклеиновых кислот ученые разных стран интенсивно изучали строение и свойства этого биоорганического соединения. Был накоплен огромный фактический материал, послуживший основой, как для последующего исследования нуклеиновых кислот, так и для практического применения результатов полученных при их изучении. В 1909 г. в результате гидролиза нуклеиновых кислот были выделены входящие в их состав сахара: рибоза и дезоксирибоза. В 1936 г. советский ученый А.Н. Белозерский впервые обнаружил ДНК в клетках растений. Это открытие имело принципиальное значение - ДНК стали рассматривать как универсальный биологический материал. В период с 1900 по 1930 г. проводятся работы по созданию хромосомной теории наследственности, в основу которой положены данные о том, что материальная структура - гены ДНК - содержат генетическую информацию. Основоположником этой теории является Томас Морган. Именно ему принадлежит приоритет в применении нового биологического объекта, который в настоящее время повсеместно используется при проведении практически всех генетических исследований. С 1909 г. Т. Морган начал использовать плодовую мушку дрозофилу как объект для изучения изменения наследственных признаков и их комбинаций. Т. Морган совместно с К. Бриджисом, Г. Меллером и А. Стертевантом разработал и экспериментально обосновал существовавшее в неявном виде представление о генах - элементарных единицах наследственности и изменчивости. По имени создателя теория получила название концепции морганизма, согласно которой единицы наследственности имеют материальную природу с конкретной локализацией в хромосомах ядра клеток всех живых организмов. Морганизм является теоретической основой хромосомной теории наследственности. В 1901 г. вышла в свет книга Г. де Фриза «Мутационная теория», в которой была дана интерпретация термина «мутация». Книга получила широкую известность, а вместе с ней в жизнь вошел и термин «мутация», хотя непосредственная связь его с ДНК была окончательно установлена гораздо позже. В 1925 г. Г.А. Надсон и Т.С. Филиппов открыли влияние рентгеновских лучей на появление наследственных изменений в эксперименте и обосновали формирование физиологических и биохимических подходов в трактовке понятия гена. Рентгеновское излучение было использовано для ускорения мутационного процесса. В конце 20-х - начале 30-х годов Н.П. Дубинин, А.С. Серебровский с сотрудниками, используя данные Г.А. Надсона и Т.С. Филиппова и результаты собственных экспериментов, доказали сложное строение гена.
Нуклеиновые кислоты являются реально существующим субстратом, который хранит, передает по наследству и воспроизводит все многообразие свойств и характеристик живых организмов. С их открытием развеялся миф об идеалистической сущности передачи наследственной информации. Было найдено конкретное химическое вещество, которое можно «потрогать руками», вещество, несущее генетическую информацию. Это открытие в значительной степени стимулировало практическое использование биологических знаний, в частности для изучения наследственных заболеваний. В 1908 г. А. Гаррод впервые проследил на практике связь между материальным носителем наследственной информации - нуклеиновой кислотой, являющейся структурной основой гена, и ферментом, кодируемым этим геном. Впервые был показан путь к изучению молекулярных основ наследственных заболеваний. Был снят мистический покров с доселе загадочного явления передачи патологических признаков от родителей потомству. Конечно, А. Гаррод знал о существовании нуклеиновых кислот и о том, что они находятся в ядре клетки, но в своем открытии он руководствовался собственными наблюдениями, статистическими исследованиями, а не имеющейся в то время скудной информацией о нуклеиновых кислотах, которые были чрезвычайно мало изучены. На основании своих наблюдений и клинического материала, накопленного к тому времени другими ученными, А. Гаррод сформулировал концепцию о врожденных болезнях, связанных с нарушением обмена веществ.
В 1926 г. А. Стертевант ввел в употребление понятие инверсии. В генетических исследованиях оно имеет большое значение. Он обнаружил это явление при изучении кроссинговера у самок плодовой мушки дрозофилы. При этом А. Стертевант обнаружил, что срединный участок одной из хромосом третьей пары перевернут на 180°, т.е. поставлен в обратном направлении. Вот этот переворот участка хромосомы и стали называть инверсией. Инверсии бывают простые (одиночные) и сложные. Причем сложные инверсии ведут к весьма значительным перестановкам блоков генов. В 1928 г. советский биолог К. Кольцов намного опережая открытие Д. Уотсона и Ф. Крика, в ясной форме высказал предположение о матричном синтезе, т.е. о том, что в настоящее время понимают под механизмом репликации и транскрипции. В 1950-1953 гг. Э. Чаргафф с сотрудниками опубликовал сенсационную серию работ, по изучению химической структуры нуклеиновых кислот. Они обследовали огромное количество разных организмов, брали образцы из различных органов и тканей. Проведенные исследования показали, что в состав ДНК, выделенной из ядер клеток человека, входят 30% аденина, 20% гуанина, 20% цитозина, 30% тимина. В то же время у бактерий например Sarcina lutea, эти цифры значительно отличаются и составляют соответственно 13%, 37%, 37%, и 13%. Эти и другие наблюдения позволили сделать вывод, что в состав ДНК разных организмов входит неодинаковое количество азотистых оснований. Но для одного и того же организма соотношение между нуклеотидами сохраняется постоянным, из каких бы клеток ни выделяли ДНК. Это значит, что во всех клетках, например, человека, ядерная ДНК будет содержать 30% аденина. И какой бы штамм бактерий Sarcina lutea ни был взят, в какие сроки и в каких бы то но было условиях ни проводились эксперименты, содержание в них аденина будет всегда равным 13%, тимина - 13% и т.д.
Итак, общее количество адениновых остатков в каждой молекуле ДНК равно количеству тиминовых остатков, а количество гуаниновых единиц - количеству цитозиновых. В дальнейшем этим открытием, получившим название «правило Чаргаффа» воспользовались Дж. Уотсон и Ф. Крик при построении моделей молекулы ДНК. На основании проведенных исследований было высказано предположение, что такая закономерность обусловлена наличием генетического кода, заключенного в структуре ДНК.
В этот же период было сделано еще одно уникальное открытие, указавшее на важную роль нуклеиновых кислот в передаче наследственной информации. Брали клетки совершенно различных, удаленных друг от друга органов и тканей. Исследования показали, что ядро любой клетки содержит примерно 6*10 мг ДНК. Только в яйцеклетках и сперматозоидах содержание ДНК было в два раза меньше, чем в клетках остальных тканей. Такое открытие вызвало два предположения. Во-первых, оно говорило об универсальных свойствах ДНК в пределах одного организма, о том, что в отношении хранения и передачи наследственной информации, заключенной в ядре клетки, все клетки организма равны, независимо от того, откуда они были взяты. Во-вторых, в любом организме имеется два типа клеток: соматические клетки - клетки тела организма (в переводе с греч. «сома» - тело) и половые клетки - клетки, связанные с размножением организмов. Между соматическими и половыми клетками существует отличие, которое проявляется в диплоидном и гаплоидном наборе хромосом. Диплоидный - это парный набор хромосом, гаплоидный - одинарный. Именно поэтому в половых клетках находится в два раза меньше нуклеиновых кислот, чем в соматических. Таким образом, вроде бы несложные количественные исследования нуклеиновых кислот дали важную по содержанию информацию. В 1950 г. Л. Полинг показал, что полипептидные цепи имеют α - спиральную конфигурацию, на основании чего он высказал предположение, что и молекула ДНК, по-видимому, имеет спиральную структуру, закрепленную водородными связями. Это послужило еще одним косвенным подтверждением существовавшего предположения о винтообразной структуре ДНК. Было показано, что возможно существование нескольких устойчивых различных конфигураций последовательности аминокислотных остатков в полипептидной цепи, одной из которых является α - спираль. Конфигурация α - спираль является одной из наиболее распространенных структур пептидной цепи. Именно такая структура дает возможность образования водородных связей между аминокислотами, находящимися рядом на смежных витках цепи. Поэтому естественно было предположить, что аналогичный механизм свойственен и для нуклеиновых кислот, так как по протяженности и числу составных элементов - в данном случае мононуклеотидов - они вполне соответствовали полипептидным цепям. В 1953 г. Д. Уотсон и Ф. Крик обосновали существование двойной спирали ДНК и впервые предложили адекватную модель молекулы ДНК, которая объяснила все факты, связанные с функционированием нуклеиновых кислот. Она показала, каким образом молекула передает информацию и воспроизводит сама себя. По сути дела, был открыт способ записи и воспроизведения генетической информации на молекулярном уровне. Д. Уотсон и Ф. Крик сами не проводили рентгеноструктурных исследований нуклеиновых кислот, но воспользовались данными М. Уилкинса и Р. Френклин и работами Э. Чаргаффа. Основным компонентом хромосом является ДНК. Д. Уотсон и Ф. Крик выделили два основных структурных свойства ДНК: ее двуспиральность и комплементарность, иначе говоря, соответствие друг другу цепей ДНК. От этих двух свойств зависит репликация генетического материала, т.е. возможность создания себе подобной структуры ДНК. В процессе репликации двойная спираль ДНК раскручивается и на каждой из цепей, как на матрице, строится комплементарная ей дочерняя цепь.(8)
Задание
1.Фрагмент одной из цепей ДНК имеет последовательность нуклеотидов:
ТАЦ-ГЦТ-ТГГ-ААТ-ТГА-ТГГ-ТАГ. Какую последовательность имеет вторая цепь ДНК?
2.Фрагмент одной из цепей молекулы ДНК имеет следующую последовательность нуклеотидов: АТТ-ГЦЦ-ГАТ-ТГГ-ГАТ-ТТГ.
В результате удвоения образовалась вторая цепь. Укажите как называется этот процесс , и напишите его структуру.
Состав нуклеиновых кислот.
При нагревании нуклеиновых кислот с хлорной кислотой они распадаются на структурные единицы, из которых построены их громадные молекулы. Другие кислоты ,как, например,HCl,вызывают очень резкую деструкцию нуклеиновых кислот с выделением NH3,свидетельствующем о разрушении входящих в их состав структурных элементов.
Среди структурных элементов нуклеиновых кислот найдены пиримидиновые основания, пуриновые основания, углеводы и фосфорная кислота.
Сам пурин не входит в состав нуклеотидов, а входят его производные - аденин (А), или 6-аминопурин, и гуанин (G), или 2-амино-6-оксипурин.
Пиримидин также не входит в состав нуклеотидов, а входят его производные - урацил (U), или 2,4-диоксипиримидин, тимин (Т), или 5-метилурацил, цитозин (С), или 2-окси-4-аминопиримидин.
В составе ДНК и РНК встречаются более редкие азотистые основания, например, 5-метилцитозин, 4-тиоурацил и дигидроурацил; они получили название минорных оснований.
В состав ДНК входят 
![]() -D-2-дезоксирибоза, в состав РНК -
-D-2-дезоксирибоза, в состав РНК - ![]() -D-рибоза. И в том, и в другом случае эти монозы являются пентозой (пять углеродных атомов), различия касаются лишь второго углеродного атома. В рибозе углерод-2 связан с ОН-группой, тогда как в дезоксирибозе на месте ОН-группы находится Н, отсюда префикс "дезокси". Буквы
-D-рибоза. И в том, и в другом случае эти монозы являются пентозой (пять углеродных атомов), различия касаются лишь второго углеродного атома. В рибозе углерод-2 связан с ОН-группой, тогда как в дезоксирибозе на месте ОН-группы находится Н, отсюда префикс "дезокси". Буквы  и D отражают специфическую конфигурацию при атомах С-1' и С-4' фуранозного цикла:
и D отражают специфическую конфигурацию при атомах С-1' и С-4' фуранозного цикла:
Нуклеозиды - соединения, в которых пуриновые или пиримидиновые основания связаны с рибозой (рибонуклеозиды) или дезоксирибозой (дезоксирибонуклеозиды). Нуклеозиды относятся к N-гликозидам: атом С-1' рибозы или дезоксирибозы связан с N-9 пуринового или N-1 пиримидинового основания(6.78.)
В состав ДНК и РНК входят следующие нуклеозиды.
ДНК
Аденин + дезоксирибоза = дезоксиаденозин.
Гуанин + дезоксирибоза = дезоксигуанозин.
Цитозин + дезоксирибоза = дезоксицитидин.
Тимин + дезоксирибоза = дезокситимидин.
РНК
Аденин + рибоза = аденозин.
Гуанин + рибоза = гуанозин.
Цитозин + рибоза = цитидин.
Урацил + рибоза = уридин.
Кроме выше перечисленных главных нуклеозидов встречаются и минорные нуклеозиды, из которых наиболее распространены дигидроуридин, псевдоуридин; в последнем отсутствует обычная N-гликозидная связь: в нем атом С-1' рибозы соединен с атомом С-5 урацила.
Нуклеозиды лучше растворимы в воде, чем исходные азотистые основания. Их легко можно разделить и идентифицировать методом тонкослойной хроматографии. Они устойчивы к щелочам, но легко гидролизуются кислотами, а также ферментом нуклеозидазой.
Нуклеотиды представляют собой нуклеозиды с присоединенной эфирной связью к остатку рибозы или дезоксирибозы фосфатной группой. В образовании связи участвует 5'-углеродный атом пентозы. В зависимости от строения пентозы все нуклеотиды можно разделить на рибонуклеотиды и дезоксирибонуклеотиды:
Уникальны биохимические функции нуклеотидов. В качестве основных можно отметить следующие:
1) являются строительными блоками нуклеиновых кислот (ДНК и РНК); участвуют в молекулярных механизмах, с помощью
которых генетическая информация хранится, реплицируется и транскрибируется;
2) выполняют важную роль в энергетическом (фосфорном) обмене, в аккумулировании и переносе энергии;
3) служат агонами (коферментами и активными простетическими группами) в окислительно-восстановительных ферментах;
4) играют важную роль в синтезе олиго- и полисахаридов, жиров.
Таким образом, нуклеотиды - универсальные биомолекулы, играющие фундаментальную роль в обмене веществ и энергии живой клетки.
Первичная структура полинуклеотидов
ДНК и РНК представляют собой полинуклеотиды, имеющие три уровня структуры: первичную, вторичную, третичную.
Специфичность нуклеиновых кислот определяется не только их нуклеотидным составом, но и последовательностью отдельных нуклеотидов в цепи нуклеиновых кислот. В состав ДНК входит всего 4 нуклеотида, но, учитывая очень высокую молекулярную массу ДНК, нетрудно представить, что разнообразие ее типов выражается поистине астрономическими цифрами. Например, если мы возьмем цепочку, состоящую только из 100 нуклеотидов, то очевидно, что она может быть построена 4 способами.
способами.
Установлено, что ДНК каждого определенного вида характеризуется только ей присущей специфичной последовательностью нуклеотидов.
Полинуклеотиды состоят из нуклеотидов, соединенных фосфорноэфирными связями с участием 3'- и 5'- углеродных атомов пентозных остатков двух соседних нуклеотидов. Длинные полинуклеотидные цепи содержат тысячи, миллионы нуклеотидных остатков. Фосфатные группы в цепях обладают сильнокислыми свойствами и при рН 7,0 полностью ионизированы. Поэтому в живых клетках нуклеиновые кислоты существуют в виде полианионов. Нуклеиновые кислоты плохо растворимы в растворах кислот. Они экстрагируются из разрушенных тканей и клеток растворами нейтральных солей или фенолом.(6.85)
Вторичная и третичная структуры ДНК
Растворы ДНК характеризуются аномальной (структурной) вязкостью. В потоке обладают двойным лучепреломлением, что объясняется удлиненной формой молекул ДНК.
В расшифровку структуры ДНК большой вклад внесли исследования Э. Чаргаффа и его сотрудников (1945-1951 гг.). Для разделения оснований, полученных при кислотном гидролизе ДНК, Э. Чаргафф использовал метод хроматографии. Каждое из этих оснований было определено спектрофотометрически. Он впервые определенно заявил, что ДНК обладают выраженной видовой специфичностью. ДНК, выделенные из различных источников, отличаются друг от друга по соотношению входящих в их состав азотистых оснований. Э. Чаргафф сформулировал закономерности состава ДНК, известные под названием правил Чаргаффа. Независимо от происхождения ДНК эти закономерности представляются следующим образом:
1) количество молекул аденина равно количеству молекул тимина (А = Т);
2) количество молекул гуанина равно количеству молекул цитозина (G = С);
3) количество молекул пуриновых оснований равно количеству молекул пиримидиновых оснований (А + G = Т + С);
4) количество оснований с 6-аминогруппами в цепях ДНК равно количеству оснований с 6-гидроксигруппами (А + С = G + Т);
5) отношение (G+С)/(А+Т) резко отличается для разных видов ДНК, но постоянно для клетки одного вида; это отношение называется фактором специфичности.
Фактор специфичности одинаков для ДНК различных органов и тканей одного организма и практически не отличается у разных видов животных и растений в пределах одного класса. У высших растений и животных его величина находится в пределах 0,55-0,93; у бактерий - 0,35-2,73.
Правила Чаргаффа сыграли решающую роль в разработке проблем молекулярной биологии. Именно они легли в основу открытия строения ДНК, ее вторичной структуры.
Прежде чем приступить к рассмотрению этой структуры, необходимо отметить следующее. Интерес к проблеме изучения структуры ДНК возрос в связи с полной неясностью механизма воспроизведения (репликации) ДНК, который отличается очень высокой степенью точности. На основании уже полученных экспериментальных данных предполагалось, что генетическая информация в живой клетке зашифрована (т.е. записана с помощью определенного кода) в специфической последовательности оснований ДНК. Однако было неясно, как воспроизводится такая последовательность.
В 1953 г. Дж. Уотсон и Ф. Крик предложили модель структуры ДНК (рис.2). Она учитывала рентгеноструктурные данные Р. Франклин и М. Уилкинса и "эквимолярность" оснований, открытую Э. Чаргаффом. Модель Уотсона - Крика не только объяснила физико-химические свойства ДНК, но и дала основание высказать предположение о возможном механизме репликации ДНК. Согласно их выводу, молекула ДНК должна быть двухцепочечной. Каждое основание одной цепи "спарено" с лежащим в той же плоскости основанием второй полинуклеотидной цепи. Это спаривание специфично; поскольку количество оснований с гидроксигруппами равно количеству оснований с аминогруппами, то, по Уотсону и Крику, только определенные пары оснований входят в структуру так, что могут образовывать друг с другом водородные связи. Так как аденин содержит аминогруппу, а тимин - гидроксигруппу, цитозин и гуанин - соответственно эти же группы и поскольку они находятся в ДНК в эквимолекулярных количествах, то разрешенными являются только пары А-Т и G-С
Между А и Т образуются две водородные связи, между G и С - три водородные связи.
Две полинуклеотидные цепи ДНК отличаются одна от другой как последовательностью оснований, так и нуклеотидным составом. Однако основания, стоящие в данном положении в одной цепи, определяют природу основания в другой цепи. Например, если в одной цепи стоит аденин, то напротив него в другой цепи будет располагаться тимин, и наоборот. Если в одной цепи стоит гуанин, то в другой обязательно будет цитозин, и наоборот. Действительно, рентгеноструктурный анализ ДНК показал, что пуриновые и пиримидиновые основания нуклеотидных остатков ДНК лежат в одной плоскости, перпендикулярной продольной оси молекулы, тогда как циклы дезоксирибозы находятся в плоскости, почти перпендикулярной той, в которой лежат циклы оснований.
Явление, при котором последовательность оснований одной цепи однозначно определяет последовательность оснований другой цепи, получило название комплементарности. Таким образом, цепи молекул ДНК комплементарны по отношению друг к другу.(6.88.)
Сформулированный Уотсоном и Криком принцип комплементарности явился универсальным принципом в биологии. Он дал начало развитию новых научных направлений - молекулярной биологии, молекулярной генетике, генной инженерии. Водородные связи обеспечивают способ спаривания оснований, стабильность двухцепочечной системы. Основания плотно упакованы, причем расстояние между центрами оснований, лежащих друг над другом, равно 0,34 нм. На каждый полный виток двойной спирали приходится 10 нуклеотидных пар. Упакованные внутри двойной спирали основания гидрофобны и недоступны молекулам воды. Ионизированные фосфатные группы и гидрофильные остатки дезоксирибозы находятся на поверхности молекулы и контактируют с молекулами воды. Таким образом, двойная спираль стабилизирована не только водородными связями между комплементарными основаниями, но и гидрофобными взаимодействиями между основаниями, расположенными вдоль длинной оси молекулы ДНК.
Третичная структура ДНК (6.88) Образуется в результате дополнительного скручивания в пространстве двухцепочечной молекулы. Она имеет вид суперспирали или изогнутой (сломанной) двойной спирали.
В настоящее время описаны три формы структуры ДНК: А-, В- и Z-формы .
Физико-химические свойства ДНК
ДНК - довольно сильная многоосновная кислота, полностью ионизированная при рН 4,0. Фосфатные группы расположены по периферии. Они прочно связывают ионы Са и Мg
и Мg , амины, гистоны - положительно заряженные белки. Устойчивость комплементарных пар оснований зависит от величины рН. Пары оснований наиболее устойчивы в интервале рН 4,0-11,0. За его пределами двухцепочечная спираль ДНК теряет устойчивость и раскручивается.
, амины, гистоны - положительно заряженные белки. Устойчивость комплементарных пар оснований зависит от величины рН. Пары оснований наиболее устойчивы в интервале рН 4,0-11,0. За его пределами двухцепочечная спираль ДНК теряет устойчивость и раскручивается.
Молекулярная масса ДНК неодинакова и зависит от источника ее получения. К тому же даже при самых тщательных и щадящих процедурах выделения ДНК подвергается некоторой деградации. Препараты, полученные современными методами из тканей животных и растений, имеют молекулярную массу 6 10 -10 10
-10 10![]() . Однако истинная молекулярная масса ДНК животных и растений, определенная по вязкости и по длине молекул, значительно выше и достигает десятков миллиардов.
. Однако истинная молекулярная масса ДНК животных и растений, определенная по вязкости и по длине молекул, значительно выше и достигает десятков миллиардов.
У большинства вирусов ДНК представляет собой двойную спираль, линейную или замкнутую в кольцо. У некоторых вирусов она представляет собой одну полинуклеотидную цепь, замкнутую в кольцо и имеющую сравнительно небольшую молекулярную массу - 2 10![]() . ДНК сравнительно легко деполимеризуется под действием некоторых химических соединений, ультразвука, ионизирующей и ультрафиолетовой радиации. Нагревание растворов ДНК до температур 70-80 °С, а также их подщелачивание вызывают денатурацию ДНК, заключающуюся в плавлении двойной спирали (разрушение водородных связей и гидрофобных взаимодействий), и расхождение полинуклеотидных цепей. Денатурация сопровождается понижением вязкости раствора, повышением поглощения в ультрафиолетовой области, увеличением отрицательного удельного вращения плоскости поляризации света, увеличением плавучей плотности образцов ДНК. В отличие от многих глобулярных белков, денатурация которых происходит постепенно в широком температурном интервале, нативные ДНК денатурируют в узком интервале температур (~10 °С), поэтому тепловую денатурацию часто называют плавлением. Температура плавления тем выше, чем больше в молекуле ДНК GС-пар; этот показатель может использоваться для определения нуклеотидного состава ДНК. Установлено, что температура плавления линейно связана с составом ДНК: ее повышение на 1° соответствует 2,5 молярных % GС-пар.
. ДНК сравнительно легко деполимеризуется под действием некоторых химических соединений, ультразвука, ионизирующей и ультрафиолетовой радиации. Нагревание растворов ДНК до температур 70-80 °С, а также их подщелачивание вызывают денатурацию ДНК, заключающуюся в плавлении двойной спирали (разрушение водородных связей и гидрофобных взаимодействий), и расхождение полинуклеотидных цепей. Денатурация сопровождается понижением вязкости раствора, повышением поглощения в ультрафиолетовой области, увеличением отрицательного удельного вращения плоскости поляризации света, увеличением плавучей плотности образцов ДНК. В отличие от многих глобулярных белков, денатурация которых происходит постепенно в широком температурном интервале, нативные ДНК денатурируют в узком интервале температур (~10 °С), поэтому тепловую денатурацию часто называют плавлением. Температура плавления тем выше, чем больше в молекуле ДНК GС-пар; этот показатель может использоваться для определения нуклеотидного состава ДНК. Установлено, что температура плавления линейно связана с составом ДНК: ее повышение на 1° соответствует 2,5 молярных % GС-пар.
IV.Практическая часть .
Опыт-эксперимент « Удивительная молекула ДНК»
Наследственность, гены, ДНК… Кажется, эти слова уже давно перестали быть научными терминами, вошли в повседневную жизнь и знакомы теперь каждому старшекласснику, не говоря уж о студентах. Но никакой ДНК большинство из нас никогда не видело, хотя увидеть её - дело вполне реальное даже в домашних условиях. Конечно, для научных работников этот метод покажется - в какой-то степени шутка и никто из них ДНК таким способом не выделяет, а между тем если и вправду воспользоваться ею, то всё получится! Выход ДНК будет, правда, невелик, а вещество - не особенно чистым, но увидеть в микроскоп длинные тонкие нити - кристаллы ДНК - вполне возможно.
Научные методы, позволяющие выделять ДНК, слишком трудны как в техническом, так и в теоретическом плане. В условиях школьных лабораторий невозможно найти нужное оборудование для проведения работы. А как хочется увидеть ДНК! За основу взят метод, предложенный В. Артамоновой в популярной статье «Как увидеть ДНК» (Химия и жизнь, Школьный клуб, 2002, №2, стр. 48-49. Алгоритм эксперимента прост в исполнении. Эксперимент нагляден, информативен по содержанию и занимателен по форме.
Объект исследования:
Выделенные из тканей животного и растения молекулы ДНК
Предмет исследования:
Структура ДНК
Выделенные из куриной печени молекулы ДНК
Химический состав нуклеопротеидов
Физические свойства ДНК
Репарация ДНК
Для этого понадобится…..
Сок свеже -выжатого ананаса 55-100 мл., либо раствора для контактных линз. Освобождает ДНК от гистоновых белков, покрывающих ее своеобразной «шубой».
Дегергент (жидкое моющее средство «Fairy») 2 столовые ложки. Разрушает липидные мембраны клеток и ядерную мембран, высвобождая ДНК.
Этанол 95% 15-30 мл. Экстрагирует молекулы ДНК из водного раствора.
Поваренная соль (NaCl) 0,9г. Создает физиологическую среду, препятствуя разрушению молекул ДНК.
Пробирки, химические стаканы или другую посуду, пипетки. Для наблюдения использовался школьный микроскоп.
Выделение ДНК из печени курицы..
Деление учащихся на группы. Каждая группа по алгоритму под руководством учителя проводит эксперимент по выделению ДНК из печени .
Алгоритм проведение эксперимента « Как самому выделить ДНК»
Методика и этапы работы:
Положите в миксер около 100 мл (полстакана) этого продукта, добавьте 1/8 чайной ложки соли и 200 мл (стакан) мл холодной кипяченой воды. Взбивайте в течение 15 секунд. Миксер «сварит» вам печеночно-клеточный суп.
Процедите смесь через ситечко или кусок капрона (чулок вполне подойдет). В полученную мякоть добавьте 1/6 от её количества (это будет примерно 2 столовые ложки) жидкого моющего средства (для посуды, например) и хорошо размешайте. Оставьте на 5-10 минут.
Разлейте жидкость по пробиркам или другим стеклянным посудинам, чтобы в каждой было заполнено не больше трети объёма.
Добавьте в каждую пробирку по чуть-чуть либо сока, выжатого из ананаса( к 2 мл суспензии клеток прибавляем 2 мл ананасового сока), либо раствора для контактных линз и осторожно встряхните, переворачивая и наклоняя пробирку (если будете трясти слишком рьяно, разломаете ДНК и ничего не увидите). Клеточная масса сжимается и опускается на дно пробирки. По времени процесс идет 10-15 минут. О том, что белки разрушены можно судить по уменьшению вязкости раствора.
Выделение ДНК из раствора, находящегося над массой клеток. Этот этап - самый ответственный. Приливать спирт в пробирку с ДНК-содержащей смесью следует осторожно пипеткой по стенкам пробирки, наслаивая его сверху. Когда нижние слои спирта смешаются с раствором ДНК, начнется процесс кристаллизации нуклеиновых кислот, и они всплывут в виде белого облачка.
Осторожно, пипеткой следует взять каплю этого облачка и поместить на предметное стекло. Покровным стеклом пользоваться не надо, так как кон-центрация ДНК в растворе невелика, в тонком слое жидкости увидеть ее сложнее. Спирт испаряется быстро, и фрагменты ДНК быстро разрушаются, поэтому каплю следует сразу поместить под микроскоп.
Конечно, увеличение школьного микроскопа не позволит увидеть структуру молекулы, и определить какие гены она содержит. Но чистые кристаллы ДНК в виде клубков, нитей, «червячков» и «запятых» видно при увеличении школьного микроскопа совершенно отчетливо. Особенно хорошо видны крупные молекулы ДНК под микроскопом, соединенным с компьютером, в этом случае их можно сфотографировать.
Примечание: Если сравнить фотографию ДНК, полученной в результате нашего опыта, с фотографиями, представленными серьезными научно-исследовательскими лабораториями, то очевидно - они очень похожи. Сравнительный анализ фото позволяет нам предполагать, что выделенный нами материал является фрагментом хромосомы.
4. Обсуждение эксперимента, оформление в тетради.
Результат
Чистые кристаллы ДНК похожи на клубки спутанных нитей, но не надо забывать, что вы видите именно кристаллы вещества, а не его макромолекулы, и сказать по их внешнему виду, какие гены содержит выделенная вами нуклеиновая кислота, конечно невозможно. Чтобы узнать это, придется снова растворять ДНК. Прочем, «прочесть» последовательность нуклеотидов домашних условиях, увы , невозможно: для этого нужны не только специальные приборы , но и дорогие реактивы. Однако если вы уже хорошо рассмотрели кристаллы и они успели подсохнуть, можете понаблюдать за тем, как ДНК растворяется. Она в начале набухает, становясь похожей на студенистую медузу, и лишь спустя несколько дней раствор делается однородным. Процесс можно ускорит, если пробирку почаще встряхивать.
Объяснения
-Размельчение в блендере разрушает стенки и органы клетки, в результате чего ДНК может плавать в супе из молекул и жиров.
-Соль мы добавляем для того, чтобы стенки клетки не полопались раньше времени: давление внутреннего содержимого на клеточную мембрану изнутри уравновешивают давлением соляного раствора снаружи.
-Фильтрация нужна, чтобы механически удалить всевозможные примеси и крупные куски ткани.
- Моющее средство из-за своего эмульгирующего воздействия притягивает жиры и отделяет их от белков.
-Но цепочки ДНК защищены белковой оболочкой. Чтобы разрушить эту оболочку и выделить чистое ДНК, вы добавляете сок ананаса. Он имеет ферменты, разрушающие внешнюю оболочку.
- Для окончательного высвобождения ДНК нужен спирт. Заменить спирт водкой или духами нельзя: если концентрация спита будет низкой и упадет при смешивании с водной фазой до 60 - 65%, ДНК в кристаллическое состояние не перейдет. По этой причине наливать спирт в пробирку с ДНК-содержащей смесью следует осторожно, наслаивая его сверху. И легкие цепочки ДНК всплывают к поверхности этого слоя, а тяжелые остатки белков и жиров остаются в растворе.
Биологические функции ДНК
Важнейшая биологическая функция ДНК - генетическая, т.е. хранение и передача наследуемых признаков. В 1943 г. О. Т. Эвери,
К. Мак-Леод и М. Мак-Карти из Рокфеллеровского института обнаружили это впервые. Они экспериментально установили, что невирулентный штамм бактерии Pneumococcus может превратиться в вирулентный простым добавлением ДНК, выделенной из вирулентных пневмококков. Исследователи заключили, что ДНК может содержать генетическую информацию. Работа О. Т. Эвери и его сотрудников признана выдающейся, представляющей собой важную историческую веху в исследовании генетической функции ДНК. Сейчас многочисленными экспериментами установлено, что ДНК - основной компонент клеточных органелл-хромосом. Трансформирующаяся ДНК включается ковалентно в ДНК невирулентной клетки (клетки-реципиента) и, таким образом, реплицируется вместе с хромосомой реципиента; свойство вирулентности наследуется. В то же время возможность передачи генетической информации бактериальным клеткам в результате введения РНК или белка не получила экспериментального подтверждения. (12.)
На вопрос, почему наследуемые признаки копируются с удивительной точностью, дает ответ принцип комплементарности. Модель ДНК, разработанная Уотсоном и Криком, четко объясняет механизм передачи информации. В связи с тем, что последовательность азотистых оснований одной цепи однозначно определяет последовательность оснований в другой цепи, репликация ДНК в клетке происходит в результате расхождения двух полинуклеотидных цепей и последующего синтеза двух новых (дочерних) цепей на старых (родительских) цепях как на матрицах. В результате образуются две дочерние двухцепочечные молекулы ДНК, идентичные родительской молекуле ДНК, содержащие по одной цепи из родительской молекулы. Такой механизм репликации был назван полуконсервативным. Он получил блестящее подтверждение в экспериментах с клетками E.coli и меченым азотом N , проведенных М. Мезелсоном и Ф. Сталем в 1957 г. Полученные ими результаты точно согласуются с полуконсервативным механизмом редупликации макромолекул ДНК. (3)
, проведенных М. Мезелсоном и Ф. Сталем в 1957 г. Полученные ими результаты точно согласуются с полуконсервативным механизмом редупликации макромолекул ДНК. (3)
V. Закрепление.
1. Какие особенности строения ДНК.
2.Какая пространственная структура молекулы ДНК.
3.В чем заключаются функции ДНК в клетке.
Тест на закрепление знаний.
1.В состав нуклеотида входят:
А) пентоза Б) гексоза В) остаток фосфорной кислоты
Г) остаток серной кислоты Д) азотистое основание
2. ДНК содержит:
А рибозу, остаток фосфорной кислоты, одно из четырех азотистых оснований: аденин, гуанин, цитозин, тимин;
Б дезоксирибозу, остаток фосфорной кислоты, одно из четырех азотистых оснований: аденин, гуанин, цитозин, тимин;
В дезоксирибозу, остаток фосфорной кислоты, одно из четырех азотистых оснований: аденин, гуанин, цитозин, урацил.
3. Основания, расположенные комплементарно друг другу:
А А - Т; Г - Ц;
Б А - Ц; Г - Т;
В А - Г; Ц - Т.
4.К первичной структурной организации ДНК относится:
А трехмерная спираль;
Б две комплементарные друг другу антипараллельные полинуклеотидные цепи;
В полинуклеотидная цепь.
5. Вторичная структура ДНК была открыта:
А Натансом и Смитом
Б Уотсоном и Криком
В Эвери, Мак-Леодом и Мак-Карти
6. Репликация - это:
А копирование ДНК с образованием 2-х идентичных дочерних молекул;
Б процесс переписывания информации с ДНК на РНК;
В процесс синтеза белка.
7. Транскрипция - это:
А Процесс самокопирования ДНК с образованием двух идентичных дочерних молекул;
Б Процесс переписывания информации, содержащейся в РНК, в форме ДНК.
В Процесс переписывания информации, содержащейся в ДНК, в форме РНК.
8 Изменение последовательности нуклеотидов в ДНК - это:
А хромосомная мутация;
Б генная мутация;
В геномная мутация.
Список литературы
1.Козлова Г.Г Онина С.А Лабораторный практикум по дисциплине «Биологическая химия» Бирск 2008.
2.«Энциклопедия для детей. Химия». Аванта Москва, 2000 год.
3.Молекулярная биология клетки Албертс Б., Брей Д., и др. Москва, 1994.
4.Биотехнология. Производство белковых веществ. В.А. Быков, М.Н. Манаков . Москва «Высшая школа» 1987г.
5.Органическая химия: учеб. для строит. спец. вузов. М.: Высшая школа, 2 Артеменко А.И. 2000год.
6. Биологическая химии. Учебное пособие для вузов. М.: Высшая школа, Березов Т.Т, Коровкин Б.Ф 1990.
7.Биологическая химия. М.: Высшая школа Кнорре Д.Г., Мызина С.Д., 1998.
8.Общая органическая химия. Под ред. Д. Бартона, У.Д. Оллиса. Нуклеиновые кислоты, аминокислоты, петиды, белки. М.: Химия, 1986.
9.Основы биохимии: Филлипович Ю.Б. учеб. для студ. хим. и биол. спец. пед. инст. М.:Высшая школа, 1985.
10.История химии белка. - Шамин А.Н. Москва : «Наука», 1977.
11. Аминокислоты, пептиды, белки. Якубке Х.-Д., Ешкайт Х. Москва: «Мир», 1985.
12.Структура и биосинтез нуклеиновых кислот. В.И Агол,А.А. Богданов В.А Гвоздев А.И Грагеров 1990год
13.Шерстнев К.И., Комаров А.Н. Химия и биология нуклеиновых кислот. М., 2000 г.
14.Ленинджер А. Биохимия. - М., 1974.
15Руководство к лабораторным и факультативным занятиям по биологии./ Под ред. Н.В. Чебышева. - М.,
1996.
16.Слюсарев А.А. Биология с общей генетикой. - М., 1979.
17.Уотсон Д. Молекулярная биология гена. - М., 1978.


