- Преподавателю
- Биология
- Изучение термодинамической возможности превращения глюкозы в организме человека
Изучение термодинамической возможности превращения глюкозы в организме человека
| Раздел | Биология |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Першина Ю.В. |
| Дата | 25.12.2015 |
| Формат | docx |
| Изображения | Есть |
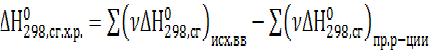
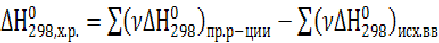
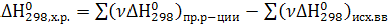
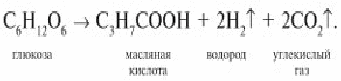
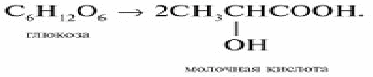
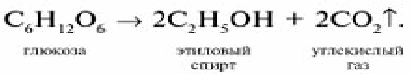
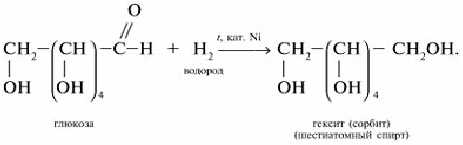
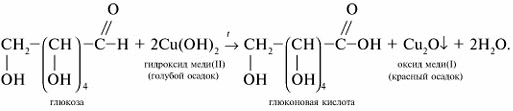
Изучение термодинамической возможности превращения глюкозы в организме человека
Автор работы ____Ю. В. Першина
Содержание
ВВЕДЕНИЕ………………………………………………………………………..4
1 Роль глюкозы для жизнедеятельности организмов………………………….5
2 Строение молекулы глюкозы и ее физико-химические свойства…………...7
3Строение молекулы глюкозы………………………………………………...…7
3.1 Физические свойства………………………………………………………….8
3.2 Химические свойства…………………………………………………………9
3.2.1 Реакции глюкозы по спиртовым группам…………………………………9
3.2.2 Реакции глюкозы по альдегидной группе………………………………..10
3.3.3 Три вида брожения глюкозы под действием различных ферментов…..11
4 Термодинамика превращения глюкозы в организме человека…………..…12
4.1 Закон Гесса и его сущность…………………………………………………13
4.2 Следствия из закона Гесса…………………………………………………..14
ЗАКЛЮЧЕНИЕ………………………………………………………….………19
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ……………………………20
Введение
Всем известно, что главными источниками энергии для человека являются определенные вещества, среди которых и углеводы. Уже стало привычным, что питательная ценность продукта описывается именно этими веществами.
К углеводам всегда было довольно неоднозначное отношение, но нельзя не признавать тот факт, что роль углеводов в организме человека довольно большая. Углеводы представляют собой один из основных и важнейших источников энергии, которые необходимы для стабильной работы абсолютно всех органов человека, а так же они способствуют укреплению мышц, нормализуют динамику роста и стабилизируют деление клеток. Расщепление углеводов является довольно быстрым процессом, в то время, когда они расщепляются, высвобождается большое количество энергии.
Химическая энергия углеводов и других молекул превращается в процессе клеточного дыхания в биологически доступную энергию макроэргических фосфатных связей. Превращение энергии, происходящее при использовании клеткой химической энергии этих фосфатных связей необходимо для работы: механической - при мышечном сокращении, электрической - при передаче нервного импульса, осмотической работы - при передвижении молекул против градиента концентраций, химической работы - при синтезе молекул в процессе роста. Часть энергии при этом теряется, рассеиваясь в форме тепла. Растения и животные выработали в процессе эволюции весьма эффективные преобразователи энергии для осуществления этих процессов, а также весьма тонкие регуляторные системы, дающие клетке возможность приспосабливаться к изменениям окружающих условий.
В данной работе рассмотрим одного из представителей углеводов - глюкозу - белое кристаллическое и сладкое вещество, которое растворяется в воде и в органических растворителях, относящееся к простым сахарам.
1 Роль глюкозы для жизнедеятельности организмов
Глюкоза находится в крови человека и животных, а так же многих сладких фруктах и овощах (апельсин, морковь, ягоды). Особенно её много в виноградном соке, поэтому глюкозу иногда называют виноградным сахаром. Мёд в основном состоит из смеси глюкозы с фруктозой. В особом виде глюкоза содержится почти во всех органах зелёных растений. В организме человека и животных глюкоза является основным и наиболее универсальным источником энергии для обеспечения метаболических процессов. Глюкоза содержится в мышцах, в крови. Повышение концентрации глюкозы в крови приводит к усилению выработки гормона поджелудочной железы - инсулина, уменьшающего содержание этого углевода в крови. В связи с исключительной важностью поддержания стабильного уровня глюкозы в крови, у человека и многих других животных существует сложная система гормональной регуляции параметров углеводного обмена. Глюкоза повышает активность человека, придает силу и выносливость при физических нагрузках.
Химическая энергия питательных веществ, поступающих в организм, заключена в ковалентных связях между атомами. В клетках глюкоза подвергается гликолизу с целью получения энергии в виде АТФ. Она так же является структурной единицей для построения большинства пищевых ди- и полисахаридов. Входе многостадийных химических реакций глюкоза превращаются в другие вещества, которые в конечном итоге окисляются до углекислого газа и воды, при этом выделяется энергия, используемая организмом для обеспечения жизнедеятельности. Способностью усваивать глюкозу обладают все клетки организма животных.
Транспорт глюкозы из внешней среды внутрь животной клетки осуществляется путём активного трансмембранного переноса с помощью особой белковой молекулы - переносчика (транспортёра) гексоз.
Процесс образования глюкозы в печени из других соединений называется глюконеогенезом. Из гликогена путём простого расщепления опять-таки легко производится глюкоза. Все это говорит о огромной роли глюкозы в жизнедеятельности организмов.
2 Строение молекулы глюкозы и ее физико-химические свойства
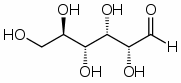
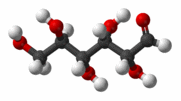
Глюкоза - моносахарид, одна из восьми изомерных альдогексоз с молекулярной формулой С6Н12О6 и молярной массой 180 г/моль.
2.1 Строение молекулы глюкозы
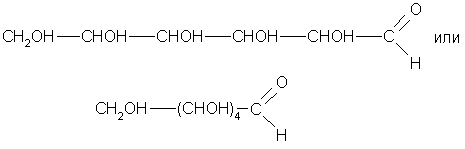
Строение глюкозы выведено на основе изучения ее химических свойств. Так, глюкоза проявляет свойства, присущие спиртам: образует с металлом алкоголяты (сахараты), сложный уксуснокислый эфир, содержащий пять кислотных остатков (по числу гидроксильных групп). Следовательно, глюкоза - многоатомный спирт. С аммиачным раствором оксида серебра она дает реакцию «серебряного зеркала», что указывает на присутствие альдегидной группы на конце углеродной цепи. Следовательно, глюкоза - альдегидоспирт, ее молекула может иметь строение
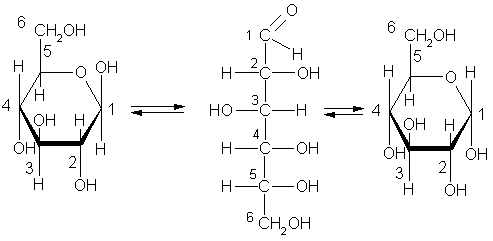
Однако не все свойства согласуются с ее строением как альдегидоспирта. Так, глюкоза не дает некоторых реакций альдегидов. Один гидроксил из пяти характеризуется наибольшей реакционной способностью, и замещение в нем водорода на метальный радикал приводит к исчезновению альдегидных свойств вещества. Все это дало основание сделать вывод, что наряду с альдегидной формой существуют циклические формы молекул глюкозы (α-циклическая и β-циклическая), которые отличаются положением гидроксильных групп относительно плоскости кольца. Циклическое строение молекулы глюкоза имеет в кристаллическом состоянии, в водных же растворах она существует в различных формах, взаимно превращающихся друг в друга:
β-циклическая
альдегидная
α-циклическая
форма
форма
форма
Как видим, в циклических формах альдегидная группа отсутствует. Гидроксильная группа, стоящая у первого углеродного атома, наиболее реакционноспособная. Циклической формой углеводов объясняются их многие химические свойства.
2.2 Физические свойства
Про физические свойства глюкозы можно сказать, что это бесцветное кристаллическое вещество сладкое на вкус, не растворимо в эфире, плохо растворимо в спирте, но хорошо растворимое в воде. Из водного раствора она выделяется в виде кристаллогидрата C6H12O6 H2O. По сравнению со свекловичным сахаром она менее сладкая. Температура плавления 146 Cº.
2.3 Химические свойства
Химические свойства глюкозы, как любого другого органического вещества, определяются ее строением. Глюкоза обладает двойственной функцией, являясь альдегидом, и многоатомным спиртом, поэтому для нее характерны свойства и многоатомных спиртов, и альдегидов.
2.3.1 Реакции глюкозы по спиртовым группам
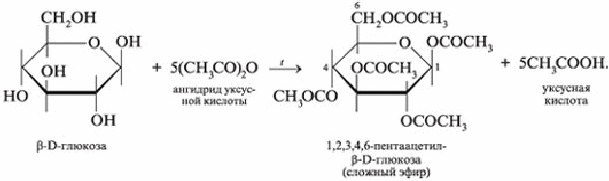
Глюкоза взаимодействует с карбоновыми кислотами или их ангидридами с образованием сложных эфиров. Например, с ангидридом уксусной кислоты:
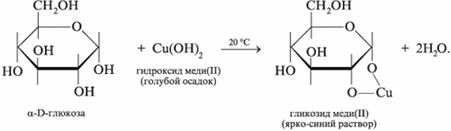
Как многоатомный спирт глюкоза реагирует с гидроксидом меди(II) с образованием ярко-синего раствора гликозида меди(II):
2.3.2 Реакции глюкозы по альдегидной группе
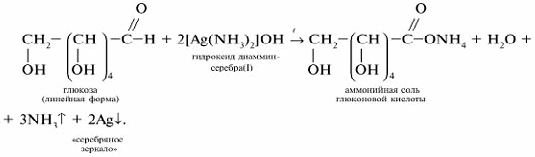
Реакция «cеребряного зеркала»:
Окисление глюкозы гидроксидом меди(II) при нагревании в щелочной среде:
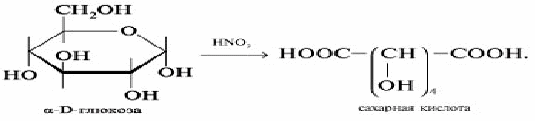
При действии бромной водой глюкоза также окисляется в глюконовую кислоту. Окисление глюкозы азотной кислотой приводит к двухосновной сахарной кислоте:
Восстановление глюкозы в шестиатомный спирт сорбит:
2.3.3 Три вида брожения глюкозы под действием различных ферментов
Спиртовое брожение:
Молочнокислое брожение:
Маслянокислое брожение:
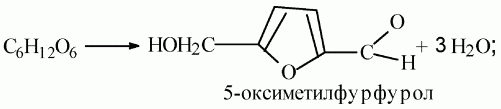
При нагревании глюкозы с концентрированными кислотами происходит дегидратация молекулы и образование оксиметилфурфурола:
3 Термодинамика превращения глюкозы в организме человека
Область физики и химии, рассматривающая энергию и ее превращения, носит название термодинамики. В ее основе лежит несколько простых принципов, приложимых к любым химическим процессам, где бы они ни происходили - в живых или в неживых системах.
В экспериментально регулируемых условиях можно измерить и сопоставить количество энергии, поступающей в любую систему и выходящей из нее. При этом всегда оказывается, что энергия не создается и не исчезает, а лишь переходит из одной формы, в другую. В этом состоит первый закон термодинамики, который иногда называют законом сохранения энергии: общее количество энергии в любой изолированной системе остается постоянным. Если данная система претерпевает изменения, переходя из исходного состояния в конечное, это может сопровождаться поглощением энергии из окружающей среды или, напротив, выделением энергии в среду. Различие между содержанием энергии системы в ее исходном и конечном состояниях точно соответствует изменению содержания энергии в окружающей среде. Теплота - это та форма энергии, в которой ее наиболее удобно измерять. Почти все физические или химические процессы сопровождаются выделением тепла в окружающую среду или поглощением тепла извне. В организме человека глюкоза подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
C6H12O6 + 6O2 6H2O + 6CO2 + 2800 кДж.
Этот процесс протекает ступенчато, и поэтому энергия выделяется медленно. Процесс, протекающий с выделением тепла, называется экзотермическим. Процесс, протекающий с поглощением тепла извне, называется эндотермическим. Во многих созданных человеком механизмах энергия чаще всего переносится в виде тепла. Однако в биологических системах дело обстоит иначе - по той простой причине, что живые организмы в основном изотермичны: температура отдельных частей клетки или отдельных клеток ткани примерно одинакова. Иначе говоря, клетки действуют иначе, чем тепловая машина; в них не происходит переноса тепла от более теплой части тела к более холодной, т. е. по градиенту температуры.
Глюкозу С6Н12О6 нельзя получить при непосредственном контакте углерода, кислорода и водорода. Это вещество возникает в результате биохимических процессов в живой клетке. В таких случаях приходит на помощь закон Гесса.
3.1 Закон Гесса и его сущность
Тепловым эффектом химической реакции называется теплота, выделяемая (поглощаемая) в результате реакции при соблюдении определенных условий:
-
Давление или объем постоянны (р = const или V = const)
-
Не совершается никакой работы, кроме работы расширения (А' = 0)
-
Температуры исходных веществ и продуктов реакции одинаковы (Т1 = Т2)
В основе термохимии лежит закон Гесса (закон постоянства сумм теплот реакций), открытый русским ученым, академиком Гессом, на основе анализа экспериментальных данных, в 1836-1840 гг. Закон Гесса гласит:
тепловой эффект химической реакции не зависит от пути и числа промежуточных стадий, а определяется лишь природой и состоянием исходных веществ и конечных продуктов.
Закон Гесса является следствием первого закона термодинамики в применении к химическим процессам при соблюдении первых двух вышеуказанных условий. Третье условие введено для удобства сопоставления тепловых эффектов.
-
Следствия из закона Гесса
Из закона Гесса вытекает несколько следствий. Следствие первое, позволяющее определить ΔН любых химических реакций через теплоты образования. Теплота образования − это тепловой эффект реакции образования 1 моля сложного вещества из простых веществ. Могут быть со знаком плюс и минус, для простых веществ равны нулю.
Согласно первому следствию из закона Гесса: тепловой эффект любой химической реакции равен разности между суммами теплот образования конечных и исходных веществ, умноженных на соответствующие стехиометрические коэффициенты в уравнении реакции.
В общем случае для любой химической реакции при р = const (изобарный процесс)
Во многих случаях теплоту образования экспериментально определить нельзя. Тогда её рассчитывают по тепловым эффектам других термохимических реакций.
Теплота сгорания - это тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов или это количество теплоты, которое выделяется при полном сгорании одного моля вещества в потоке кислорода.
За нуль принимаются теплоты сгорания кислорода и продуктов сгорания в их устойчивом состоянии при стандартных условиях, т.е. считают нулевой энергию сгорания газообразных веществ О2, N2, CO2, SO2, H2O(ж) и др. негорючих веществ.
Согласно второму следствию из закона Гесса: тепловой эффект любой химической реакции равен разности между суммами теплот сгорания исходных веществ и конечных продуктов, умноженных на соответствующие стехиометрические коэффициенты:
Особенно большое значение теплоты сгорания имеют для определения тепловых эффектов химических реакций, в которых участвуют органические соединения. Теплота сгорания пищевых продуктов в живом организме является источником энергии, за счет которых осуществляются жизнедеятельность. Химические превращения пищевых веществ в организме, как и химические реакции вне организма, подчиняются одним и тем же термохимическим законам. Например, при сжигании одного моля глюкозы в калометрической бомбе выделяется ≈673 ккал тепла, причем точно такое же количество тепла освобождает организм человека при окислении одного моля глюкозы.
Из первого следствия закона Гесса можно определить стандартную теплоту образования глюкозы, пользуясь энтальпией ее сгорания:
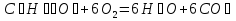
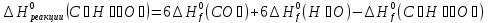 ;
;
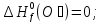
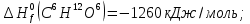
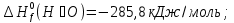
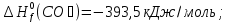
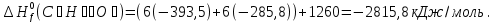
Поскольку почти все превращения энергии сопровождаются потерей некоторого количества тепла, обусловленной беспорядочным движением молекул, энтропия окружающей среды при этом повышается. Живые организмы и составляющие их клетки высокоорганизованны и поэтому их энтропия невелика. Они сохраняют это «низкоэнтропийное» состояние за счет повышения энтропии внешней среды. Когда мы едим конфеты и превращаем содержащуюся в них глюкозу в двуокись углерода и воду, которые выделяются во внешнюю среду, мы повышаем энтропию среды. Стремление к состоянию с максимальной энтропией - движущая сила всех процессов. Выделение организмом тепла или поглощение тепла из окружающей среды приводит систему организм - среда к состоянию с максимальной энтропией.
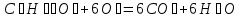
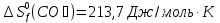 ;
;
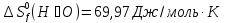 ;
;
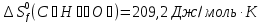 ;
;
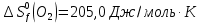 ;
;
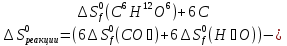 ));
));
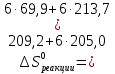 .
.
Кроме того, имеется так называемая свободная энергия. Ее можно рассматривать как ту часть общей энергии системы, которая способна производить работу в изотермических условиях. Энтропия и свободная энергия связаны известной зависимостью; увеличение энтропии при необратимом процессе сопровождается уменьшением количества свободной энергии. Все физические и химические процессы протекают с уменьшением свободной энергии до тех пор, пока не достигнется состояние равновесия, при котором свободная энергия системы минимальна, а энтропия максимальна. Свободная энергия - это полезная энергия, а энтропия служит мерой энергии, которую уже нельзя использовать.
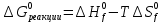 ;
;
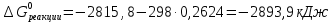 .
.
Если принять, что эти реакции протекают в стандартных условиях, а для термодинамических расчетов это значит, что температура равна 25  , или 298 К, и давление равно 1 атм (760 мм рт. ст.), то на 1 моль окисленной глюкозы приходится
, или 298 К, и давление равно 1 атм (760 мм рт. ст.), то на 1 моль окисленной глюкозы приходится 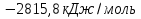 теплоты.
теплоты.
Исходя из закона Гесса, следует, что при разложении 1 моль глюкозы в результате гликолиза выделится 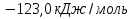 энергии:
энергии:
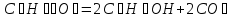
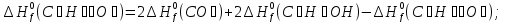
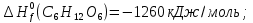
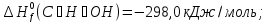
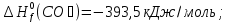
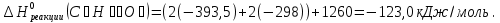
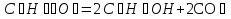
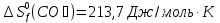 ;
;
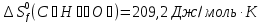 ;
;
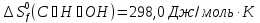 ;
;
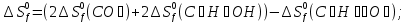
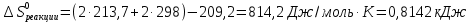 .
.
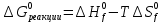 ;
;
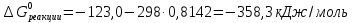 .
.
Таким образом, процесс окисления глюкозы в организме человека дает больше энергии, чем ее разложение.
Другие следствия из закона Гесса:
-
Тепловой эффект химического соединения равен и противоположен по знаку тепловому эффекту его образования (Закон Лавуазье-Лапласа). Следствие - тепловой эффект кругового процесса должен быть равен 0
-
Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между их тепловыми эффектами представляет тепловой эффект перехода из одного начального состояния в другое.
-
Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница между их тепловыми эффектами представляет процесс перехода из одного конечного состояния в другие.
Заключение
Живые организмы подчиняются всем основным законам природы. К ним полностью применим закон сохранения и превращения энергии, а так же второе начало термодинамики.
В процессе жизнедеятельности любой организм, растительный и животный, осуществляет постоянный обмен вещества с окружающей средой. Он поглощает в виде пищи разнообразные вещества, ассимилирует и трансформирует их в состав своего тела, а затем в процессе диссимиляции разрушает и удаляет в виде отработанных продуктов во внешнюю среду. Многочисленные эксперименты установили, что все эти процессы подчиняются закону сохранения материи.
Необходимую для процессов жизнедеятельности энергию живой организм получает из пищевых продуктов, которые являются носителями химической энергии высокого потенциала. При распаде этих веществ в организме энергия высвобождается и используется организмом как тепловая, как механическая работа и в реакциях различного синтеза. Продукты распада живого организма содержат значительно меньше химической энергии, поэтому приложимость второго начала термодинамики к органическому миру не вызывает сомнений. Все это дает основание для общего вывода: для живых организмов, как и для тел неживой природы, полностью выполняются законы термодинамики, а так же можно говорить о том, что аэробный процесс расщепления глюкозы энергетически более выгоден, чем анаэробный.
Список использованных источников
1 Балезин, С. А. Основы физической и коллоидной химии / С. А Балезин, Б. В Ерофеев, Н. И Подобаев. - М: Просвещение, 1975.
2 Болдырев, А.И. Физическая и коллоидная химия / А.И. Болдырев - М.: Высш. шк., 1983. - 408 с.
3 Волькенштейн М.В. Энтропия и информация. М.: Наука, 1986. 192 с.
4 Горшков, В. И. Физическая химия / В. И Горшков, И. А Кузнецов. - М.: МГУ, 2000. - 344 с.
5 Карапетьянц, М. Х. Введение в теорию химического процесса /
М. Х. Карапетьянц. - М: Высшая школа, 1983, 231 с.
6 Кнорре, Д. Г. Физическая химия / Д. Г Кнорре, Л. Ф Крылова, В. С. Музыкантов. - М.:Высшая школа, 2003. - 285 с.
7 Кудряшева, Н.С. Физическая химия : учебник для бакалавров / Н. С. Кудряшева, Л.Г. Бондарева. - М. : Издательство Юрайт, 2013. - 340 с. - Серия : Бакалавр. Базовый курс.
8 Малахова, А. Я. Физическая и коллоидная химия / А. Я Малахова. - Мн.: Вышэйшая школа, 1981. - 315 с.
9 Никольский, Б. П. Физическая и коллоидная химия / Б. П Никольский. - Л.: Химия, 1987, 879 с.
10 Уильяме, В. Физическая химия для биологов / В. Уильяме, Х.Уильяме. - М: Мир, 1976.
11 Хмельницкий, Р. А. Физическая и коллоидная химия / Р. А Хмельницкий. - М.: Высшая школа, 1988.
12 Чанг, Р. Физическая химия с приложениями к биологическим системам / Р. Чанг. - М.: Мир, 1999. - 419 с.
13 Шершавина, А. X. Физическая и коллоидная химия / А. Х Шершавина. - Мн.: Университетское, 1995.


