- Преподавателю
- Биология
- Проект по биологии на тему Сохранение рябчика малого методами биотехнологии (9 класс)
Проект по биологии на тему Сохранение рябчика малого методами биотехнологии (9 класс)
| Раздел | Биология |
| Класс | 9 класс |
| Тип | Другие методич. материалы |
| Автор | Москалёва Е.С. |
| Дата | 06.01.2016 |
| Формат | doc |
| Изображения | Есть |
СОХРАНЕНИЕ РЯБЧИКА МАЛОГО МЕТОДАМИ БИОТЕХНОЛОГИИ
Автор:
Юлия Моторина, ученица 9а класса
Руководитель: преподаватель биологии, магистр биологических наук Москалева Екатерина Станиславовна
Научный консультант:
к.б.н. Додонова Александра Шавкатовна
Астана 2012 г.
ВВЕДЕНИЕ
В настоящее время экологическое мышление стало необходимым не только для решения насущных прикладных задач нашей жизни, но и для формирования грамотного и бережного отношения к окружающей нас природе. В международной сфере работают специальные комиссии ЮНЕСКО, ЮНЕП и другие организации, задачей которых является пропаганда и внедрение экологических подходов в разные сферы практической деятельности человека.
Масштабы современного взаимодействия общества с природой определяется в основном небиологическими потребностями человечества. Человеческая деятельность на планете изменяет климат, влияет на состав атмосферы и Мирового океана. В прошлом было немало примеров деградации среды и подрыва экономики целых народов в результате стихийного развития взаимоотношений с природой. В настоящее время эта опасность грозит всему человечеству. В условиях современной хозяйственной деятельности человека реальна возможность полного подрыва естественных воспроизводительных сил природы, множатся примеры безвозвратных потерь отдельных популяций и видов живых организмов, ухудшается экологическая обстановка на нашей планете.
В настоящее время главной угрозой биоразнообразию флоры является, помимо постоянного ухудшения экологической обстановки, сельскохозяйственное растениеводство, так как в угоду монокультурам перепахиваются миллионы гектаров земли. Защита от истребления естественных растительных сообществ задача очень сложная, потому что наряду с полным уничтожением местообитаний редких видов растений остро стоит проблема обеспечения пищевыми ресурсами все увеличивающегося человеческого сообщества [1]. Современный экологический кризис возникает именно из-за глобальных воздействий на живой покров, подрыва естественных регуляторных механизмов природы. Возможности управления этими механизмами первую очередь связаны с экологической проблемой сохранения и поддержания генетического разнообразия жизни. Экология продолжает развивать свои методы и подходы, внедряясь во все формы взаимоотношений с природой и смыкаясь с широким фронтом других наук. С конца 80-х годов прошлого столетия стала активно обсуждаться возможность сохранения растений биотехнологическими методами. В настоящее время методические подходы, используемые для сохранения генофонда растений можно разделить на две группы: 1) хранение биологических объектов, замедляя процессы их роста (медленно растущие коллекции); 2) хранение при остановке роста (криосохранение). Для сохранения культуры в состоянии роста необходимо поддерживать устойчивый рост - изменять кинетику роста. Основной целью при создании растущих коллекций должно быть сохранение физиологической стабильности (жизнеспособности) [2].
Актуальность: сохранение редкого вида рябчик малый методами биотехнологии является актуальной задачей т.к. позволит не только депонировать культуру ткани в коллекции in vitro, но и в дальнейшем восстановить поврежденные дикие популяции этого вида.
Цель исследования: получение культуры клеток рябчика малого и изучение ее характеристик, разработать рекомендации по сохранению вида в культуре клеток.
Задачи:
-
Отработка методов стерилизации растительного материала
-
Получение каллусной ткани рябчика малого и изучение ростовых характеристик культуры
-
Изучение влияния маннитола на сохранение жизнеспособности культуры клеток рябчика малого
-
Исследование микроклонального размножения культуры рябчика малого
Научная значимость: биотехнологическое изучение рябчика малого проводится впервые. Применение наукоемких технологий для сохранения данного вида позволит расширить наше понимание процессов, происходящих в популяциях растительных клеток при дедифференциации и дифференциации.
Практическая ценность данной работы заключается в том, что предлагаемая технология позволит эффективно сохранить редкий вид рябчик малый, который нуждается в охране.
АНАЛИЗ РАБОТ
Необходимость сохранения любого растения независимо от его практического использования не вызывает сомнения, так как потеря биологического вида является невозместимой. Задача сохранения исходного генофонда должна решаться на уровне современных представлений о сложности структуры вида, то есть, необходима охрана всей совокупности экологических рас и внутривидовых форм, отражающих потенциальные возможности вида. Как правило, наиболее уязвимыми оказываются редкие и эндемичные растения, которые имеют небольшие природные запасы и узкие ареалы. Так, на территории Казахстана под охрану взято более 300 видов растений, из которых на территории Центрального Казахстана произрастает более 70 видов, их них 37 нуждается в охране и дальнейшем изучении.
Работы по интродукции, семеноводству и культивированию редких, исчезающих и эндемичных видов растений широко представлены по Казахстану, в странах ближнего и дальнего зарубежья.
В настоящее время технологии клонального микроразмножения активно используются для производства растений во всем мире. Однако, как правило, это либо декоративные виды, либо виды растений, востребованные народным хозяйством. С помощью технологий клонального микроразмножения можно ускорить размножение новых сортов, получить высококачественный посадочный материал, применение которого значительно повышает продуктивность растений [3]. Это особенно важно для ускорения распространения новых сортов и форм кустарников и деревьев, на размножение которых от исходного экземпляра уходит 15-20 лет. Если у растения существует проблема семенного размножения, может быть разработана экономически более выгодная технология клонального микроразмножения [4].
Как известно, процесс культивирования клеток in vitro сопровождается значительными изменениями генома. На разных этапах культивирования клеток уровень, причины и механизм геномной изменчивости различны. При длительном культивировании тканей большинства видов растений наблюдается потеря ими морфогенетического потенциала, и длительно растущая на искусственной среде привыкшая культура теряет способность к регенерации [5]. Однако, есть данные, когда рост и развитие сомаклонов были нормальными и единообразными, заметных фенотипических вариаций не наблюдалось, не выявлено аномалий на цитологическом и генетическом уровнях [6]. Из вышесказанного можно сделать вывод, что необходимо изучение фенотипической изменчивости, а также биохимических и генетических вариаций индивидуально у каждого вида. Также, видимо, имеет смысл сокращение периода дедифференцированного состояния растительной ткани.
МЕСТО И ВРЕМЯ ВЫПОЛНЕНИЯ РАБОТЫ
Работа выполнялась на базе лаборатории лекарственных растений АО «НПЦ «Фитохимия» МОН РК, г. Караганда в течение 12 месяцев 2006-2007 годов.
КРАТКОЕ ОПИСАНИЕ ИСПОЛЬЗОВАННЫХ МЕТОДИК
Получение и изучение каллусных тканей проводились с соблюдением стерильных условий. Пересадку культивируемых объектов проводили в ламинарном боксе ЛБ-Г с продувкой стерильным воздухом.
Культивационные среды стерилизовались в автоклаве при 1,2 атмосферы в течение 20 мин. Культивирование проводили в чашках Петри диаметром 120 мм в световом шкафу при комнатной температуре.
В экспериментах по культивированию клеток и тканей использовали общие методические приемы, описанные в монографиях Р.Г. Бутенко [7], Ф.Л. Калинина и других [8].
Основными факторами, влияющими на дедифференциацию эксплантов, являются ауксины и цитокинины. В качестве ауксина использовали 3-индолилуксусную кислоту (ИУК), в качестве цитокинина - 6-бензиламинопурин (БАП).
Культивирование каллусных тканей проводили на агаризованной среде Мурасиге - Скуга [9], (таблица 1) на свету и без доступа света в затемнённом помещении с периодом субкультивирования 3-4 недели, при температуре 25оС.
Таблица 1 - Состав питательной среды Мурасиге - Скуга
Компоненты
Концентрация мг/л.
1
2
Макроэлементы
NH4NO3
1650
KNO3
1900
CaCl24H2O
440
MgSO47H2O
370
KH2PO4
170
Микроэлементы
MnSO44H2O
KI
0,83
H3BO3
6,2
ZnSO47H2O
8,6
CuSO45H2O
0,025
Na2MoO4
0,25
CoCl26H2O
0,025
Источники железа
FeSO47H2O
27,8
Na2-EDTA
37,3
Органические вещества
Мезоинозит
100
В-1
0,1
В-6
0,5
РР
0,5
Сахароза
30000
рН
5,6-5,8
Скорость роста оценивали по значению ростового индекса (РИ), вычисляемого по формуле:
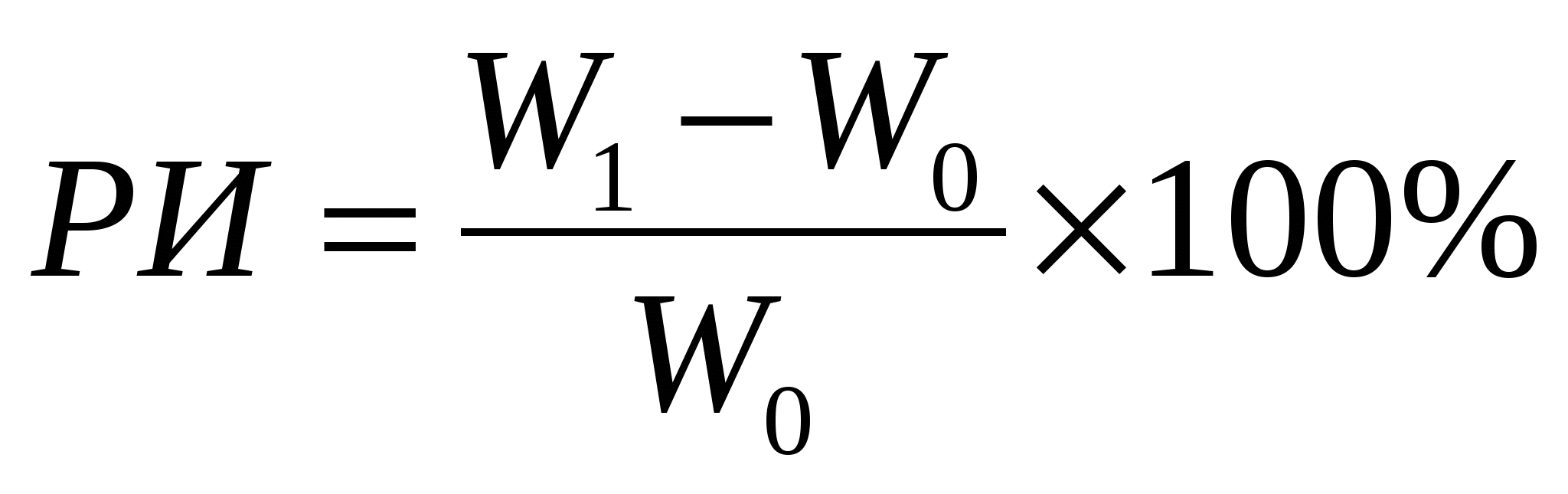 ,
,
где W0 - начальная масса экспланта,
W1 - масса каллуса, в конце цикла культивирования.
Для стерилизации органов и тканей растений, из которых будет изолироваться ткань для культуры, применяют различные стерилизующие вещества (таблица 2). Эти вещества должны обеспечивать наибольший процент неповрежденных тканей, способных к росту и новообразованиям при наименьшем проценте инфекции [7].
Таблица 2 - Стерилизующие растворы
Стерилизующий агент
Стерилизуемый материал
Концентрация
Экспозиция
Хлорная известь
Корни, молодые побеги.
9%
10-30 мин
Точки роста
5%
15 мин
Семена
3,5%
-
Гипохлорид кальция
Любой
1-9 %
15 мин
Сулема (рекомендуется добавлять детергенты)
Любой
0,1%
-
Перекись водорода
10-12%
8-12 мин
Спирт
(обжиг пламенем)
Крупные семена, плоды
96%
Техника стерилизации растительного материала:
Перед стерилизацией объекты должны быть тщательно вымыты теплой водой с мылом и щеткой и промыты дистиллированной водой. После стерилизующего раствора промывают 3 раза в стерильной дистиллированной воде и используют для изоляции тканей, а семена помещают на поверхность питательной среды для прорастания. При стерилизации мелких объектов (семян, почек и др.) рекомендуется использовать марлевые мешочки или сита, чтобы не растерять растительный материал в процессе манипуляций.
СИСИТЕМАТИЗИРОВАННЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Рябчик малый (Fritillaria meleagroides Patrin.et Schult. ex Schult., Liliaceae) представляет собой многолетнее травянистое растение (Рисунок 1.), 25-60 см высотой, с шаровидной луковицей 1,5 см в диаметре, образованной 2 чешуями. Стебель с 3-7 узколинейными очередными листьями. Цветки верхушечные, одиночные или нередко по 2-3. Околоцветник с буро-фиолетовыми и темно-крапчатыми долями 25-35 мм длиной. Плод - шестигранная коробочка. Цветет во второй половине весны (с апреля по начало июня) [10].
Экология и биология. Луковичный эфемероид. Предпочитает селиться по луговым и лугово-кустарниковым зарослям в местах с высокой степенью увлажнения. В природе размножение исключительно семенное. Тенденция изменения ареала и численности вида. Вид распространен в Сибири, Казахстане, Европе. Из-за хозяйственной деятельности человека, а также сборов на букеты сокращается число популяций и количество особей в них. За последние 10-15 лет перешел из разряда уязвимых видов в категорию редких. Вид нуждается в охране [11-13].
Клубни рябчика малого содержат много крахмала, употреблялись в пищу вместо хлеба, кроме того этот вид широко применяется в китайской и тибетской медицине.

Рисунок 1 - Растения рябчика малого
Для получения каллусной ткани рябчика малого использовали луковички растений, собранных в период цветения в Карагандинской области, так как в природных популяциях, да и в культуре, именно луковички являются органом вегетативного размножения изучаемого вида. Определены условия стерилизации растительного материала рябчика малого. Экспланты стерилизовали в 50 %-ном этиловом спирте в течение четырех минут, затем высаживали на агаризованную среду Мурасиге-Скуга, содержащую 500 мг/л ампициллина для устранения посторонней микрофлоры и стимуляторы роста: БАП и ИУК, для индукции процессов дедифференциации.
Сравнительно высокую каллусообразующую способность показали экспланты из сердцевины луковичек рябчика малого - 802,6 %, полученные ткани имеют бледно-зеленую окраску, рыхлую однородную консистенцию (рисунок 2).
Исследовано влияние различных концентраций ауксинов и цитокининов на ростовые характеристики полученных каллусных тканей рябчика малого. В результате проведенных экспериментов определено, что оптимальным для роста является присутствие в питательной среде 6-бензиламинопурина - 0,5 мг/л, 3-индолилуксусной кислоты - 2 мг/л.

Рисунок 2 - Каллусная ткань рябчика малого
Исследована динамика ростовой активности культуры клеток рябчика малого в течение 30 суток на среде МС, содержащей 3-индолилуксусной кислоты - 2 мг/л, 6-бензиламинопурина - 0,5 мг/л. Для этого определяли вес биомассы каждые трое суток. На основании полученных данных построена кривая роста (рисунок 3).
Из представленного рисунка видно, что кривая, описывающая рост неморфогенной каллусной ткани рябчика малого имеет характерную S-образную форму. Сложно выделить лаг-фазу, до 21 суток культивирования рост практически линейный, затем характерные фаза экспоненциального роста (21-24 сутки) и стационарная фаза (до 30 суток культивирования). Максимальная ростовая активность культуры составила 257%. Оптимальными сроками пересева культуры нами выбраны 24-26 сутки культивирования в период максимального прироста, когда еще не начались процессы деградации.
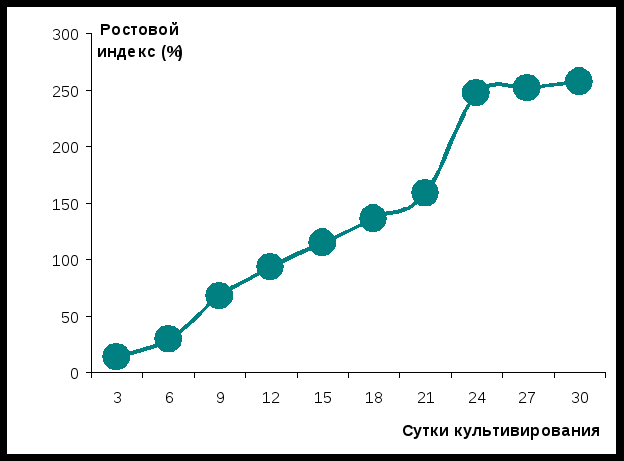
Рисунок 3 - Динамика ростовой активности каллусной
ткани рябчика малого
Изучение влияния маннитола на сохранение жизнеспособности тканей рябчика малого
Наряду с традиционными методами сохранения растений ex situ большее значение приобретает использование для этих целей культуры изолированных тканей и клеток, создание коллекции in vitro. Одним из основных подходов хранения растительного материала in vitro является минимизация роста культуры.
Обеспечение минимального роста достигается за счет уменьшения минеральной основы питательной среды, изменения физических условий культивирования. Требуется также в некоторых случаях, добавление в среду ретардантов, осмотически активных веществ, физиологически активных веществ. Существует несколько способов лимитирующих рост. Один из таких - внесение в питательную среду веществ, способных замедлить рост (ретардантов). Они могут оказывать осмотическое или гормональное воздействие.
Задачей данного этапа явилось изучение влияния маннитола на ростовые характеристики и жизнеспособность каллусной ткани рябчика малого в течение длительного времени (100 суток). Для этого в питательную среду добавляли маннитол в концентрациях 1 и 0,5%. Исследовали сохранение жизнеспособности (количество живых тканей) в течение трех месяцев. Полученные результаты представлены на рисунке 4.
По полученным данным видно, что более высокое содержание маннитола (1%) в среде способствует лучшему сохранению жизнеспособности культуры рябчика малого. Количество жизнеспособных тканей почти не меняется с течением времени, на 100 сутки составляет 36%. А в присутствии 0,5% маннитола через 40 суток количество жизнеспособных каллусных культур оставалось 22%, по истечении 100 суток живыми остались только 5% тканей.
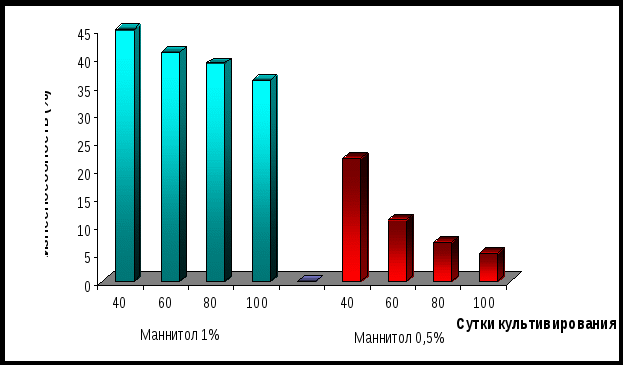
Рисунок 4 - Влияние маннитола на сохранение жизнеспособности
каллусной ткани рябчика малого
Таким образом, при создании коллекции лучше использовать питательную среду с содержанием маннитола в концентрации 1%.
Индукция морфогенеза в каллусной ткани рябчика малого
Культивирование коллекции in vitro подразумевает возможность регенерации целого растения из депонируемой каллусной ткани. Для этого необходимо разработать методику получения сначала морфогенных структур, а затем образования органов и наконец формирования целого растения. Из всех факторов клонального микроразмножения, наибольшее значение имеет генотип исходного растения, определяющий возможность к микроразмножению. В большинстве случаев наблюдается прямая корреляция между способностью к вегетативному размножению и размножению in vitro [7].
Было исследовано влияние различных концентраций фитогормонов на морфогенез в тканях рябчика малого. Исследовали следующие сочетания концентраций фитогормонов: БАП - 4 мг/л, ИУК - 0,1 мг/л; БАП - 4 мг/л, ИУК - 0,5 мг/л; БАП - 2 мг/л, ИУК - 0,1 мг/л; БАП - 2 мг/л, ИУК - 0,5 мг/л. Наблюдения вели в течение 30 суток, подсчитывали количество образовавшихся стрелок листьев и зачатков луковичек. В результате проведенного эксперимента определено, что максимальное количество морфогенных структур рябчика малого формируется на среде с содержанием БАП - 2 мг/л, ИУК - 0,5 мг/л. Кроме того, следует отметить, что в присутствие таких концентраций стимуляторов роста каллусная ткань приобретает зеленую окраску, новообразования также имеют зеленый цвет. Формирование стрелок листьев происходит непосредственно в массиве каллусной ткани, без предварительного образования луковичек (рисунок 5).

Рисунок 5 - Морфогенные структуры рябчика малого на среде МС,
содержащей БАП - 2 мг/л, ИУК - 0,5 мг/л
На среде дополненной БАП - 2 мг/л, ИУК - 0,1 мг/л каллусная ткань рябчика малого имела желтую, желто-зеленую окраску. Стрелки листьев формировались также без предварительного формирования луковичек, но интенсивность данного процесса меньше, чем в случае содержания фитогормонов БАП - 2 мг/л, ИУК - 0,5 мг/л.
Увеличение концентрации БАП до 4 мг/л не способствовало индукции морфогенеза в каллусной ткани рябчика малого. Каллусная ткань, культивируемая на средах, с содержанием БАП - 4 мг/л, ИУК - 0,1 мг/л; БАП - 4 мг/л, ИУК - 0,5 мг/л имела глобулярную рыхлую структуру, окрашена в зеленый, желто-зеленый цвет, при чем меньшие концентрации ИУК способствуют более светлой, ближе к желтой, окраске. Стрелки листьев образовывались в 2-7 случаях, что на порядок меньше, чем на среде, содержащей БАП - 2 мг/л, ИУК - 0,5 мг/л.
Кроме того, нами было изучено влияние света на морфогенез в культуре клеток рябчика малого. Определено, что в темноте формирование стрелок листьев не происходит, а в массиве каллусной ткани образуются белые луковички, в структуре которых можно выделить этиолированную редуцированную стрелку листа. Дальнейшее развитие полученных в темноте луковичек не происходит. Оптимальной концентрацией для образования луковичек в темноте является БАП - 2 мг/л, ИУК - 0,1 мг/л. При переносе полученных морфогенных структур в условия освещенности этиолированные побеги зеленеют, и происходит формирование дополнительных стрелок листьев.
Таким образом, оптимальным сочетанием фитогормонов для индукции морфогенеза является БАП - 2 мг/л, ИУК - 0,5 мг/л, так как в этом случае формирование морфогенных структур в каллусной ткани рябчика малого происходило наиболее интенсивно. Отмечено, что необходимым условием морфогенеза рябчика малого является наличие освещения. Возможно, процесс образования луковичек в темноте связан с тем, что этот орган у интактного растения расположен под землей, без доступа света, поэтому в отсутствие освещения создаются условия оптимальные именно для образования луковичек.
Формирование растеньиц рябчика малого
Полученные морфогенные структуры рябчика малого переносили на среду МС без стимуляторов роста и углеводов с пониженным содержанием агар-агара. На этой среде происходило вытягивание стрелок, иногда увеличение их количества до 2-3, кроме того, формировались чешуи луковичек (рисунок 6). И стрелки листьев и чешуи луковиц имеют характерную для рябчиков окраску - бордово-коричневые крапинки.

Рисунок 6 - Стрелки растеньиц рябчика малого на среде МС
без содержания сахарозы и стимуляторов роста
Через 2-3 месяца происходило формирование корнеобразных структур в основании луковиц. Эти сформировавшиеся растеньица были адаптированы к условиям закрытого грунта (рисунок 7).
Таким образом, разработан метод получения пробирочных растений рябчика малого, растущих на искусственных питательных средах из морфогенных структур культуры клеток.


А Б
Рисунок 7 - Формирование растеньиц рябчика малого
А - Формирование корней; Б - Растение рябчика малого в закрытом грунте
ОСНОВНЫЕ ВЫВОДЫ
1. Получена каллусная ткань рябчика малого из луковиц. Определено, что оптимальным для роста каллусной ткани рябчика малого является присутствие в питательной среде МС 6-бензиламинопурина - 0,5 мг/л, 3-индолилуксусной кислоты - 2 мг/л.
2. Изучена динамика ростовой активности культуры клеток рябчика малого. Максимальная ростовая активность культуры составила 257 %. Оптимальными сроками пересева культуры являются 24-26 сутки культивирования.
3. Для сохранения ростовой активности каллусной культуры рябчика малого оптимальной является концентрация маннитола в среде 1%, при этом живыми остаются до 40% тканей после трех месяцев культивирования.
4. Оптимальным сочетанием фитогормонов для индукции морфогенеза является БАП - 2 мг/л, ИУК - 0,5 мг/л. Отмечено, что необходимым условием морфогенеза рябчика малого является наличие освещения.
5. Отработана методика получения растений, имеющих стрелки листьев и корни, которые могут быть адаптированы к условиям закрытого грунта.
РЕКОМЕНДАЦИИ
При создании коллекции культур клеток рябчика малого лучше использовать питательную среду с содержанием маннитола в концентрации 1%.
ФАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ РЕЗУЛЬТАТОВ ПРОЕКТА
Полученные результаты используются для создания коллекции культур клеток редких, эндемичных лекарственных растений на базе АО «НПЦ «Фитохимия» в лаборатории биотехнологии лекарственных растений.
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
-
Прохоров А.А. Редкие виды растений России, нуждающиеся в сохранении ex situ // Материалы международного симпозиума «Нетрадиционные и редкие растения, природные соединения и перспективы их использования».- Белгород.- 2006.- Т.2.- С.292-293.
-
Митрофанова И.В. Минимализация роста декоративных растений под воздействием химических факторов в культуре in vitro // Материалы международной конференции «Биология клетки in vitro и биотехнология».- Саратов.- 2003.-С.202-203.
-
Молканова О.И., Беляева Ю.Е., Стахеева Т.С., Васильева О.Г. Использование биотехнологических методов для воспроизводства фиторесурсов // Биология клетки in vitro и биотехнология / Мат.межд.конф. - Саратов, 2003. - С.208-209.
-
Попович Е.А. Некоторые аспекты клонального микроразмножения декоративных растений // Биология клетки in vitro и биотехнология / Мат.межд.конф. - Саратов, 2003. - С. 258-259.
-
Аш О.А., Кузнецова О.И., Хартина Г.А., Гостимский С.А. Изучение регенерации растений из длительно культивируемого каллуса // Биология клетки in vitro и биотехнология / Мат.межд.конф. - Саратов, 2003. - С. 30-31.
-
Binsfeld Pedro, Schnable Heide Analysis of somatic embryogenic-derived somaclones of perennial heliantus spesies // J.Аppl.Bot.- 2000.- 74, № 5-6.- С. 224-228.
-
Бутенко Р.Г. Культура изолированных тканей и физиология морфогенеза растений. - М: Наука, 1964. - 250 с.
-
Калинин Ф.Л., Сарнацкая В.В., Полищук В.Е. Метод культуры изолированных тканей в физиологии и биохимии растений. - Киев: Наука, 1980. - 488 с.
-
Murashige I., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiology Plant. -1962. - № 15. - Р. 473-497.
-
Флора Казахстана. Т. 9. - Алма-Ата: Наука, 1966. - 425 с.
-
Иващенко А.А. О состоянии популяций редких видов семейства лилейных в Южном Алтае // Ботанические исследования в Казахстане.- Наука.- Алматы.- 1988. - С. 13.
-
Красная книга Казахской ССР. Редкие и находящиеся под угрозой исчезновения виды животных и растений. Ч. 2. Растения. - Алма-Ата: Наука, 1981. - 260 с.
-
Куприянов А.Н. Охраняемые растения в Карагандинской области. - Караганда, 1993. - 38 с.


