- Преподавателю
- Биология
- Интегрированный урок по биологии и химии по теме Углерод
Интегрированный урок по биологии и химии по теме Углерод
| Раздел | Биология |
| Класс | - |
| Тип | Конспекты |
| Автор | Киряева Т.В. |
| Дата | 17.10.2014 |
| Формат | doc |
| Изображения | Есть |
Тема урока: « Углерод»
Тип урока: интегрированный
Цели: сформировать представление ребят об углероде, как простом веществе и его биохимическом цикле.
Задачи: 1. Образовательные: Рассмотреть строение, аллотропию, сравнительные свойства и применение углерода, на примере алмаза и графита. Познакомить учащихся с явлением адсорбция и его практическим значением. Разобрать химические свойства, биохимический цикл углерода, его применение.
2. Воспитательные: Формирование мировоззрения через раскрытие причинно-следственных связей о строении атома; формирование политехнизма через применение углерода в различных отраслях производства; формирование экологической культуры, на примере влияния деятельности человека на биосферу.
3. Коррекционно- развивающие: Развитие химического и биологического языка, памяти, мышления, речи. Формирование умений и навыков анализа, сравнения, самостоятельной работы с учебником.
Методы:1. Словесные (объяснение, беседа, рассказ, опрос, самостоятельная работа)
-
Наглядные (таблицы, рисунки, презентация, работа с учебником)
-
Практические (демонстрационный опыт, работа за компьютером)
Оборудование: 1. Таблицы: «Периодическая система Д.И. Менделеева» и «Растворимости».
-
Рисунки: «Звезда ордена Св. Андрея Первозванного», Алмаз «Шах», «Большая императорская корона», «Малая императорская корона», «Скипетр императорский», «Устройство противогаза», «Круговорот углерода в природе» и «Применение углерода».
-
Модели кристаллических решеток углерода и графита.
-
Уголь активированный, графит.
-
Шкатулка; полезные ископаемые: каменный уголь, мел, известняк, мрамор.
Ход урока
I. Орг. момент
Здравствуйте ребята! Сегодня на уроке повторим и закрепим строение, физические свойства элемента фосфора и его соединения. Изучим химические свойства фосфорной кислоты. А также перейдем к изучению нового химического элемента.
III. Изучение новой темы
Вступительное слово учителя:
«Зовется он царем живой природы Им пишут, жгут его,
Хотя в земной коре и в воздухе его совсем не много.
Короны царей бывшей Российской Империи украшал его род,
А в химии он просто углерод!
Как вы поняли речь пойдет о химическом элементе углероде».
Тема урока: « Углерод» (запись на доске)
1 .Строение атома углерода.
(опрос, ученик у доски)
Химический элемент углерод находится во 2-ом периоде, 4-ой группе, главной подгруппе.
На внешнем энергетическом уровне у него 4 электрона, поэтому углерод может отдавать их или принимать электроны, отсюда степень окисления равна +4; -4, например, А14С3 +4;
С-402 ; Н2С+403
(запись на доске).
Учащиеся легко разбирают строение атома и прогнозируют окислительно-восстановительные свойства углерода:
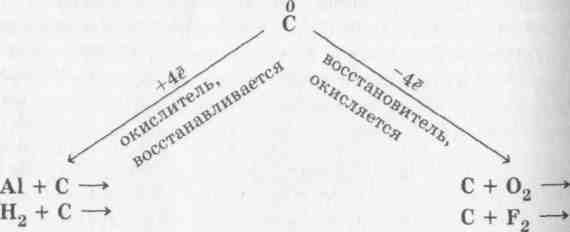
(соответствующие уравнения учащиеся записывают самостоятельно).
2. Физические свойства углерода.
Углерод имеет две аллотропные модификации.
(ученики рассказывают заранее подготовленный материал об алмазе, графите, саже и древесном угле).
Сообщение 1:
Алмаз - прозрачное кристаллическое вещество, самое твердое из всех природных веществ. Он служит эталоном твердости, которая по десятибалльной системе оценивается высшим баллом 10. Кристаллы алмаза обычно бесцветные, но бывают синего, голубого, красного и черного цветов. Они имеют очень сильный блеск благодаря высокой светопреломляющей и светоотражающей способности. Алмазы были известны еще в древности. Само слово «алмаз» происходит или от арабского алмас, что означает «твердейший», или от греческого слова адамас, т. е. «несокрушимый, непреодолимый». Массу алмазов измеряют в каратах, 1 карат соответствует 0,2 г. Алмазы - это не только камни ювелиров. Благодаря исключительно высокой твердости алмазов они применяются для изготовления буров, сверл, шлифовальных инструментов, резки стекла. Ограненные прозрачные алмазы называются бриллиантами.
Собрание исторических бриллиантов и изделий из них хранится в Алмазном фонде Оружейной палаты МосковскомКремля и золотых кладовых Санкт-Петербгского Эрмитажа.
(презентация с рисунками Звезды ордена Св. Андрея Первозванного, Алмаза «Шах, Большой императорской короны, Малой императорской короны, Скипетра императорского)
Звезда ордена Св. Андрея Первозванного. Золото, серебро бриллианты, сапфиры. 8,0x8,0 см. 1805 - 1815 гг.
Алмаз «Шах». На нем три надписи на персидском языке. Камень найден в Центральной Индии в конце XVI в. Алмаз «Щах» - один из семи исторических камней Алмазного фонда.
Большая императорская корона. Корона состоит из золота, серебра, бриллиантов, шпинели, жемчуга. Она сделана к коронации императрицы Екатерины II.
Малая императорская корона. Эта корона с превосходными индийскими бриллиантами не имеет себе равных в Европе. Одно из лучших произведений ювелирного искусства начала XIX в. (1801 г.).
Скипетр императорский сделан из золота, серебра, эмали, бриллиантов, алмаза «Орлов». Длина скипетра с орлом 59,5 см. Начало 70-х гг. XVIII в. Алмаз «Орлов» был подарен императрице Екатерине II графом Орловым в 1774 г.
Сообщение 2:
Графит - темно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском. В отличие от алмаза графит мягкий (оставляет след на бумаге) и непрозрачный, хорошо проводит тепло и электрический ток.
Из графита изготовляют электроды, твердые смазки, замедлители нейтронов в ядерных реакторах, стержни для карандашей. При высоких температурах и давлениях из графита получают искусственные алмазы, которые широко применяются в технике.
Сообщение 3:
Сходное с графитом строение имеют сажа и древесный уголь. Древесный уголь получают при сухой перегонке древесины. Этот уголь благодаря своей пористой поверхности обладает замечательной способностью поглощать газы и растворенные вещества. Это свойство называется адсорбцией. Чем больше пористость древесного угля, тем эффективнее адсорбция. Чтобы увеличить поглотительную способность, древесный уголь обрабатывают горячим водяным паром. Обработанный таким способом уголь называют активированным или активным. В аптеках его продают в виде черных таблеток карболена. (рисунок «Устройство противогаза»)
На поглотительной способности активированного угля основано действие противогазов - устройство для защиты от вредных примесей, имеющихся в воздухе. Первый противогаз был изобретен выдающимся русским химиком Н. Д. Зелинским и спас жизнь тысячам солдат в период первой мировой войны.
Активированный уголь широко применяется в промышленности для очистки многих продуктов, например спирта, от сивушных масел, сахарного сиропа от окрашенных веществ, для улавливания бензина из природных газов. (запись в тетради)
Адсорбция - способность поглощать газы и растворенные вещества.
( рассказ учителя, демонстрация кристаллической решетки алмаза и графита)
Твердость алмаза обусловлена особой структурой его атомной кристаллической решетки. В ней каждый атом углерода окружен такими же атомами, расположенными в вершинах тетраэдра. Мягкость графита обусловлена слоистой структурой. В кристаллической решетке графита атомы углерода, лежащие в одной плоскости, прочно связаны в правильные шестиугольники. Связи между слоями малопрочны.
3. Химические свойства углерода. (объяснение учителя)
1. Сажа и уголь взаимодействуют с кислородом
С + 02 → С02
2. С металлами, при температуре
4А1 + ЗС → А14С3 (демонстрационный опыт на компьютере)
3. При прокаливании черного порошка оксида меди с порошком древесного угля, смесь
приобретает красный цвет из-за образовавшейся в результате реакции меди
С + 2СuО → 2Сu + С02
4. Физ минутка для снятия напряжения глаз - диаграмма.
5. Биологическое значение углерода.
(рассказ учителя биологии, с использованием рисунка «Углерод в природе»)
В природе углерод встречается в свободном состоянии (алмаз, графит - демонстрация) и в форме соединений, главным образом карбонатов. Основным карбонатным минералом является кальцит СаСО2,который образует известняк, мел и мрамор (демонстрация).
В атмосфере содержится оксид углерода - СО2 - углекислый газ.
На столе лежит волшебная шкатулка. Разгадайте загадку и вы узнаете, что в ней.
«Черен как ворон, а греет как солнце». Правильно - каменный уголь.
Вспомните из курса биологии, какой период в истории Земли носит название каменноугольного. К какой эре принадлежит этот период?
Каково происхождение каменного угля?
Углерод - основная часть каменного угля. Углерод - «рождающий уголь»
Латинское название - карбонеум, в основе содержит корень карбо - уголь.
Нефть является смесью соединений углерода, главным образом с Н. Их так и называют - углеводороды. Они являются главной составной частью природного газа.
Углерод - особый химический элемент.
Он основа многообразия органических соединений, из которых построены все живые организмы на нашей планете.
Все перечисленные источники С участвуют в круговороте его в природе. Демонстрация. Что происходит в процессе дыхания у живых организмов? (при дыхании высвобождается С в виде СО2)
- Что происходит с углекислым газом в процессе фотосинтеза? (превращается в органические соединения)
Из атмосферы и природных вод СО2 поглощается зелеными растениями (фотосинтез), а в результате процесса дыхания, брожения, гниения СО2 снова поступает в атмосферу и воды морей и океанов.
Всего за 7-8 лет живые организмы пропускает через свои тела весь С, содержащийся в атмосфере. В океане (в основном в составе фитопланктона) 40 1012 кг С в год фиксируется в процессе фотосинтеза в виде СО2; На суше фиксируется в год 35 1012 кг С при фотосинтезе в виде СО2 ; 5 1012 кг С в год высвобождается при сжигании топлива.
При разрушении горных пород содержащиеся в них металлы при действии атмосферного СО2 образуют осаждающиеся карбонаты. Большие количества СО2 выделяются при извержении вулканов.
В последнее время поступление С в атмосферу вследствие деятельности человека резко возросло. Что может привести к серьезным последствиям для биосферы. Что может произойти? (парниковый эффект).
-
Применение углерода.
(ученики по очереди читают вслух по учебнику применение углерода. Используется рисунок, аналогичный схеме в учебнике «Применение углерода») (беседа)
Углерод применяется в качестве адсорбента, в производстве сахара, для приготовления черной краски, для очистки спирта, в производстве синтетического бензина, в качестве наполнителя при получении резины, для получения карбида кальция, для получения искусственных алмазов, в медицине, составная часть крема для обуви.
IV. Закрепление полученных знаний
Тестовое задание: (самостоятельная работа на компьютерах)
1. А14С3 - это соединение называется:
а) карбонат алюминия б) карбид алюминия в) кальцит
2. CaС03 - это соединение называется:
а) углекислый газ б) карбид кальция в) мел, мрамор, известняк
3. Способность поглощать газы и растворенные вещества - это явление:
а) аллотропия б) адсорбция в) флотация г) демеркуризация
4. Аллотропные модификации углерода:
а) сажа, алмаз, уголь, графит б) сажа, мрамор, уголь, графит
в) сажа, алмаз, торф, графит г) сажа, алмаз, уголь, мел
5. Нефть - это смесь:
а) углерода с азотом б) углерода с кислородом в) углерода с водородом.
V. Вывод по уроку: Углерод - это особый химический элемент. Он основа многообразия органических соединений, из которых построены все живые организмы на нашей планете.
VI. Домашнее задание: Химия - п. 28, упр. № 8. Биология - 221-223


