- Преподавателю
- Биология
- Методические указания по выполнению лабораторных работ по дисциплине «Естествознание»
Методические указания по выполнению лабораторных работ по дисциплине «Естествознание»
| Раздел | Биология |
| Класс | - |
| Тип | Другие методич. материалы |
| Автор | Болдырева А.Ю. |
| Дата | 07.09.2015 |
| Формат | doc |
| Изображения | Есть |
ФГБОУ ВПО «Московский государственный гуманитарно-экономический университет» Калмыцкий филиал
Методические указания
по выполнению лабораторных работ
по дисциплине «Естествознание»
для специальностей
100701 «Коммерция», 030912 «Право и организация социальной работы», 080114 «Экономика и бухгалтерский учёт»
г. Элиста, 2015 год
Утверждено научно-методическим
советом ФГБОУ ВПО «МГГЭИ» КФ
«__» _____________2015г.
Председатель:_____(Новгородова В. В.)
Рассмотрено на заседании кафедры
образовательных дисциплин
Протокол № ___ от_________2015 г.
Зав. кафедрой________Санджиева А.Э.
Автор: Болдырева А.Ю.
преподаватель КФ «МГГЭИ»
Рецензент: Басангова Г.В.
преподаватель КФ «МГГЭИ»
Асархинова Е.Б.
преподаватель химии ЭАДК
Содержание
1. Пояснительная записка……………………………………….4
2. Правила выполнения лабораторных работ………………….5
3. Лабораторная работа № 1
Методы очистки воды Анализ содержания примесей в воде…………………………………………………..……………6
4. Лабораторная работа № 2
Устранение жесткости воды…………………………………….8
5. Лабораторная работа № 3
Определение химического состава атмосферы. Измерение уровня СО2……………………………………………………….10
6. Лабораторная работа № 4
Механизм образования кислотных дождей……………………14
7. Лабораторная работа № 5
Определение содержания витамина С в напитках…………….16
8. Лабораторная работа № 6
Определение содержания железа в продуктах……………… ..18
9. Лабораторная работа № 7
Рассматривание клеток и тканей в оптический микроскоп………………………………………………………..20
10. Лабораторная работа № 8
Действие слюны на крахмал……………………………………24
11. Литература…………………………………………………...25
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Методическое пособие к выполнению лабораторных работ по дисциплине «Естествознание» по разделам «Химия с элементами Экологии» и «Биология» составлено на основе рабочей программы в соответствии требований государственного стандарта Министерства образования и науки РФ и предназначено для закрепления теоретических знаний; приобретения необходимых практических навыков и умений для студентов специальностей 100701 «Коммерция», 030912 «Право и организация социальной работы», 080114 «Экономика и бухгалтерский учёт».
Учебно-воспитательные задачи курса химии, биологии решаются в процессе усвоения студентов основных понятий, научных фактов, законов, теорий и ведущих идей, составляющих основу для подготовки студентов к трудовой деятельности и формирования их научного мировоззрения. Эксперимент открывает возможность формировать у студентов специальные предметные умения работать с химическими веществами, выполнять простые лабораторные опыты, учит студентов безопасному и экологически грамотному обращению с веществами, приборами в быту и на производстве.
Лабораторные работы являются химическими и биологическими практикумами, которые служат не только средством закрепления умений и навыков, но также и средством контроля над качеством их сформированности. Цель настоящего руководства к лабораторным занятиям не только экспериментальное раскрытие теоретических положений естествознания, но также и формирование навыков научно-исследовательской деятельности у студентов первого курса. Для овладения общими способами организации самостоятельной работы предлагается схема последовательности действий, которой следует руководствоваться при подготовке к лабораторным работам, их проведении и оформлении отчета.
В пособии подробно рассмотрены основные приемы при работе с химическим оборудованием, сформулированы правила выполнения лабораторных работ и правила техники безопасности при работе в кабинете химии. Кроме того, дано краткое описание техники химического и биологического эксперимента. По каждой теме лабораторных занятий формулируются задания, которые должны будут выполнить студенты.
Правила выполнения лабораторных работ.
-
Студент должен придти на лабораторное занятие подготовленным по данной теме.
-
Каждый студент должен знать правила по технике безопасности при работе в химической лаборатории (и при работе с реактивами в данной работе).
3. После проведения работы студент представляет письменный отчет.
4. До выполнения лабораторной работы студент проходит тестирование по выявлению уровня его теоретической подготовки по данной теме.
5. Отчет о проделанной работе следует выполнять в тетрадях для лабораторных работ с одной стороны листа. Содержание отчета указано в описании лабораторной работы.
-
Таблицы и рисунки следует выполнять карандашом, записи - ручкой. Рисунки выполняются в левой половине листа, наблюдения и выводы в правой части листа. Уравнения реакций записываются во всю строку (после наблюдений и выводов).
-
Оценку по данной лабораторной работе студент получает при положительных оценках за работу и отчет, общий зачет - при наличии оценок по всем лабораторным работам.
ЛАБОРАТОРНАЯ РАБОТА № 1
Тема: «Методы очистки воды. Анализ содержания примесей в воде».
Цель работы: научиться очищать воду от механических примесей и уметь определять содержание примесей в воде.
Оборудование: делительная воронка, фильтровальная бумага, раствор соляной кислоты, хлорид бария, нитрат серебра, тиоцианата калия.
Краткие теоретические сведения
Получение чистой воды - очень важная проблема. Чистая вода необходима многим отраслям современной промышленности, она используется для проведения многих технологических процессов. Очищенная питьевая вода применяется в бытовых целях. В природной воде всегда имеются механические примеси и растворённые вещества. Вода - прекрасный растворитель и поэтому невозможно встретить в природе жидкую «чистую» воду, то есть ту воду, в которой не растворены неорганические и органические вещества. В результате жизнедеятельности человека количество загрязняющих воду веществ постоянно растёт, и на сегодняшний день их насчитывается более 50 000. Поэтому проведение тестов на определение концентрации такого количества химических веществ, которые могут присутствовать в воде, просто невозможно.
Традиционно для оценки качества воды используют физические, санитарно - бактериологические и химические показатели.
К физическим показателям относят температуру, запахи и привкусы, цветность и мутность.
К санитарно-бактериологическим показателям относят бактериальную загрязнённость воды, загрязнённость кишечной палочкой, содержание в воде токсичных и радиоактивных микрокомпонентов.
К химическим показателям относят водородный показатель воды рН, жёсткость и щёлочность, минерализацию, а также содержание главных ионов. Качество воды определяется содержанием ионов, обуславливающих жёсткость воды, а также ионов тяжёлых металлов Рb2+, Рg2+, Cr3+, Fe3+, SO42-,Cl-, Mg2+, которые часто встречаются в стоках промышленных предприятий
Выполнение работы:
Опыт № 1. Очистка воды методом фильтрования.
Приготовьте делительную воронку, поместив в неё фильтр. Вылейте на фильтр воду с механическими примесями. Что наблюдаете?
Опыт № 2. Очистка воды методом перегонки.
Соберите устройство. Изучите работу прибора.
Опыт № 3. Обнаружение ионов SO42-.
К 3 мл анализируемой воды добавьте 2-3 капли 1М раствора соляной кислоты, нагрейте до кипения и прибавьте 0,5 мл хлорида бария. Что наблюдаете? Напишите уравнение реакции.
Опыт № 4. Обнаружение ионов Cl-.
К 3 мл анализируемой воды прилейте по каплям 0,1М раствора нитрата серебра. Что наблюдаете? Напишите уравнение реакции.
Опыт № 5. Обнаружение ионов Fe3+.
К 0,5 мл анализируемой воды прилейте 1мл 0,5 М раствора тиоцианата калия (KNCS). Что наблюдаете? Напишите уравнение реакции.
Контрольные вопросы:
1. Как получить дистиллированную воду и почему она вредна для организма?
2. Почему не проводят исследование воды на все химические примеси?
Выводы
ЛАБОРАТОРНАЯ РАБОТА № 2
Тема: «Устранение жёсткости воды».
Цель работы: научиться устранять жёсткость воды.
Оборудование: дистиллированная вода, пипетки, мыльный раствор, известковое молоко, питьевая вода.
Краткие теоретические сведения
Природная вода, проходя через горные породы, обогащается солями кальция и магния. Это объясняется растворимостью сульфатов магния и кальция; кроме этого, в присутствии углекислого газа и воды нерастворимые карбонаты превращаются в растворимые гидрокарбонаты:
МеСO3 +CO2 +H2O= Ме (H СO3)2
Если содержание солей в воде незначительно, то воду называют мягкой (дождевая вода), в противном случае - жёсткой (речная, морская вода).
Различают карбонатную (временную) жёсткость воды, обусловленную наличием в воде гидрокарбонатов магния и кальция, некарбонатную (постоянную) обусловленную присутствием в воде сульфатов, хлоридов магния и кальция, а также других солей.
Общая жёсткость = карбонатная жесткость + постоянная жёсткость. В жёсткой воде плохо развариваются продукты питания и плохо завариваются чай, кофе. Постоянное употребление жёсткой воды может привести к отложению солей в организме. В такой воде плохо мылится мыло (не даёт пены), а ткань, впитывая соли, становится жёлтой и быстро ветшает; вода непригодна для паровых котлов и трубопроводов, так как при нагревании жёсткой воды соли кальция и магния осаждаются на внутренних стенках, образуя накипь. Накипь имеет низкую теплопроводность, поэтому затрудняет нагревание воды. Это вызывает увеличение расхода топлива. Кроме того, из-за накипи металл котла перегревается и быстро изнашивается.
Выполнение работы:
Опыт № 1. Определение жёсткости воды.
В одну пробирку налейте 5 мл. дистиллированной воды, а в другую столько же жёсткой. В обе пробирки приливайте по каплям (из пипетки) мыльный раствор (после прибавления каждой капли пробирку встряхивайте) до появления устойчивой пены. Объясните результаты опыта.
Опыт № 2.Устранение жёсткости воды кипячением.
Налейте в пробирку 5 мл. жёсткой воды и прокипятите. Дайте ей остыть. Слейте осторожно воду с осадка и приливайте к ней по каплям мыльный раствор. Запишите уравнение реакции.
Опыт № 3. Устранение жёсткости воды действием известкового молока.
Налейте в пробирку 5 мл. жёсткой воды и добавьте к ней 3 мл. известкового молока. Запишите уравнение реакции.
Опыт № 4. Устранение жёсткости воды действием соды.
Налейте в пробирку 5 мл. жёсткой воды и добавьте к ней несколько грамм питьевой соды. Запишите уравнение реакции.
Контрольные вопросы:
1. Некоторые почвы при действии на них соляной кислоты «вскипают». Чем это объясняется? Составьте уравнение реакции.
2. Как удалять накипь со стенок стиральных машин?
Выводы
ЛАБОРАТОРНАЯ РАБОТА № 3
Тема: «Определение химического состава атмосферы. Измерение уровня СО2».
Цель работы: определить химический состав атмосферы, выявить уровень углекислого газа в атмосфере.
Оборудование: медицинский шприц на 20 мл; 0,005% раствор карбоната натрия; фенолфталеин.
Краткие теоретические сведения
Определение химического состава атмосферы.
Загрязнения атмосферы выбросами промышленных предприятий отрицательно влияет на здоровье людей, на функционирование природных систем. Потери несут и сами основные загрязнители - промышленные предприятия, так как выбросы в атмосферу способствуют коррозии оборудования и строительных конструкций.
Воздух жилых и производственных помещений содержит гораздо больше опасных загрязнителей, чем атмосферный. Действие загрязнителей на организм человека внутри помещения длительнее, чем на открытом воздухе. В помещениях человек проводит в среднем 60-80% своего времени. Загрязнение воздуха производственных помещений также отличается разнообразием и наличием специфических ЗВ, связанным с особенностями технологий производства. Здесь действие ЗВ усугубляется их высокими локальными концентрациями и сопутствующими факторами среды (температурой, излучением и др.)
Выполнение работы:
Опыт 1. Метод определения углекислого газа в воздухе
В медицинский шприц на 20 мл наберите 5 мл 0,005% раствора карбоната натрия с фенолфталеином, имеющего розовую окраску, а затем наберите 20 мл воздуха.
Встряхивайте в течение 1 мин. Если не произошло обесцвечивание раствора, воздух из шприца осторожно выжмите, оставив в нем раствор, затем вновь наберите порцию воздуха 20 мл и снова встряхивайте в течение 1 мин. Эту операцию нужно повторять до обесцвечивания раствора. Объясните изменение цвета поглотительного раствора при пропускании воздуха, напишите уравнение реакции. Предложите способ расчета содержания углекислого газа в воздухе на основании опыта и сравните полученный результат с литературными данными.
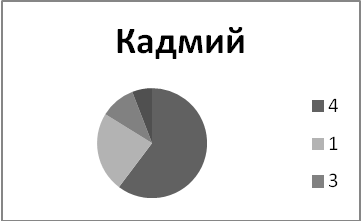
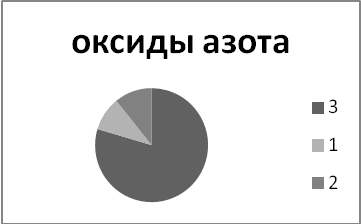
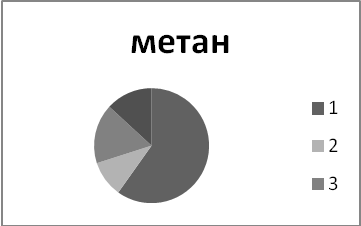
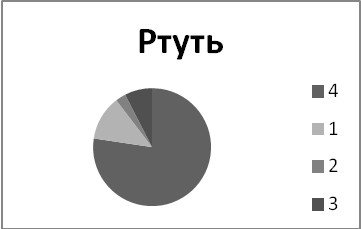
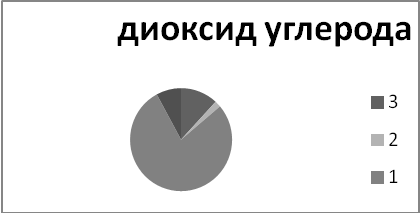
Опыт 2. Проанализируйте рисунок. Выясните, какой вклад в производство различных токсикантов, загрязняющих атмосферу, вносит промышленность? Вспомните, какое влияние оказывают эти соединения на человека и окружающую среду в целом?
1- промышленные источники энергии; 2- традиционные источники энергии; 3 - сельское хозяйство; 4 - промышленные производство (по Дж. Холдрену, 1990)



Контрольные вопросы:
1. Используя литературные данные, охарактеризуйте кратко источники поступления определенного загрязняющего вещества в атмосферу и его экологические последствия.
2. Сравните общие принципы, на которых основаны определения загрязняющих веществ с помощью индикаторных трубок и на таких современных приборах, как хроматографы.
3. Обсудите тот факт, что примерно в 50% существующих методик определения загрязняющих веществ в воздухе, где процедуры отбора пробы и самого определения разделены, использует спектрофотометры или фотоэлектроколориметры для окончания анализа.
Выводы
ЛАБОРАТОРНАЯ РАБОТА № 4
Тема: «Механизм образования кислотных дождей».
Цель работы: изучить механизм образования кислотных дождей.
Оборудование: текст «Механизм образования кислотных осадков»; стакан, ложка, целлофановый пакет, пробы снега или дождя.
Краткие теоретические сведения
Основной причиной повышения кислотности являются выбросы оксида серы (4), который превращается в оксид серы (6) благодаря окислению за счёт кислорода воздуха, озона, пероксида водорода в воздухе, присутствию оксидов металлов, выполняющих роль катализаторов, и атмосферной влаге. 60% кислотности в осадках получается за счёт серной кислоты, 30% - за счёт азотной и 5% - соляной.
Кислотным называют дождь (снег), рН которого ниже 5,6.
Загрязнение атмосферы соединениями серы. Соединения серы попадают в атмосферу естественным путем (вулканическая деятельность) и в результате антропогенной деятельности человека (сжигание ископаемого топлива, которое содержит серу). В процессе горения часть серы окисляется до SO2. Среди используемых видов топлива первое место по поставке диоксида серы занимает каменный уголь, второе - нефть, третье - природный газ. Наиболее распространенными соединениями серы, поступающими в атмосферу, являются диоксид серы (SO2),сульфиты (S04), сероуглерод (CS2) и сероводород (Н2S). Содержание серы в угле достаточно велико. В процессе горения сера превращается в сернистый газ, а часть серы остается в золе в твердом состоянии.
Загрязнение атмосферы соединениями азота. Оксиды азота образуются в атмосфере естественным и антропогенным путем (сжигание всех видов природного топлива (12 млн.т./год), транспорт (8 млн.т./год) и промышленность (1 млн.т./год)).
N0 - образуется в малых количествах в цилиндрах двигателей внутреннего сгорания при прямом взаимодействии кислорода с азотом. В среднем выделение N0 автомобилем - 1-2 г на 1 км. Вступает в реакцию кислородом: 2NО (г) + О2 = 2 N02 , поэтому некоторое количество диоксида азота присутствует в выхлопных газах двигателей внутреннего сгорания. Газообразный диоксид азота растворяется в капельках влаги с образованием азотной кислоты: ЗN02 + Н20 = 2НN03 + N0
Выполнение работы:
-
По предложенному тексту составить схему «Механизм образования кислотных осадков»;
-
Изучить и представить графически кислотность осадков в вашем районе на протяжении 2 недель, собирая дождь (снег) в чистые стеклянные ёмкости непосредственно при выпадении осадков.
Чтобы измерения были достоверными, необходимо правильно отобрать пробы снега:
1) Выбрать площадку для отбора проб, на которой можно построить треугольник со сторонами не менее 10 м (10 - 30 м).
2) В вершинах треугольника разметить квадраты со сторонами 1 м. Получится 3 таких квадрата.
3) Пробы берут по углам квадрата (4 штуки) и в центре. Всего собирают 5 проб с квадрата. Три квадрата дают 15 проб.
4) Снег берут почти на всю глубину снежной толщи. Это позволяет суммировать все загрязнения. Все 15 проб складывают в один целлофановый пакет, ёмкость. Отбирать снег лучше стаканом, ложкой, стараясь не касаться руками (предварительно вымытыми) снега и внутренней поверхности пакета. Собранный снег хранить в холодильнике, на балконе, за окном. Пробы целесообразно отбирать около заводов, у дорог, в парках, скверах, в жилых массивах города.
Ход анализа:
Перед анализом снег растопить и довести до комнатной температуры (200 С). После этого в воду опустить индикаторную бумажку на некоторое время и сравнить цвет с цветной шкалой, определить значение рН. Данные записать, отметить место отбора пробы, время отбора. Оформите свои наблюдения, сделайте выводы
Контрольные вопросы:
-
Пронаблюдать за состоянием деревьев в районе, где вы живёте, близ заводов, у дорог. Если у деревьев начинают уродливо расти ветви, а корни высыхают, это является признаком отравления сернистым газом в сочетании с озоном.
-
Спрогнозируйте все последствия загрязнения экосистем сернистым газом.
Выводы
ЛАБОРАТОРНАЯ РАБОТА № 5
Тема: «Определение витамина С в напитках».
Цель работы: определить содержания витамина С в напитках.
Оборудование: колба, пипетка, раствор витамина С, бюретка, раствор йода, крахмал.
Краткие теоретические сведения
Витамин С, известный также как аскорбиновая кислота относится к водорастворимым витаминам. Очень неустойчив, легко реагирует с кислородом и теряет активность под действием света и тепла. Анализ выполняется методом титрования и основывается на взаимодействии витамина С с иодом:
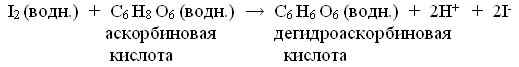
Задание. Определите содержание витамина С в напитках (группам предложить для анализа разнообразные напитки, включая молоко).
Выполнение работы:
1. В колбу емкостью 125 мл пипеткой отмерьте 25 мл раствора витамина С (концентрация 1 г/л), добавьте 10 капель 1% суспензии крахмала.
Бюретку заполните раствором иода и медленно по каплям добавляйте его в колбу. Продолжайте добавлять, пока в колбе не появится синяя окраска, устойчивая в течение 20 секунд. Запишите какой объем раствора иода израсходован.
Рассчитайте коэффициент пересчета, разделив 25 мг витамина С на объем (в мл) используемого раствора иода, и запишите в тетрадь (размерность мг витамина С/мл раствора иода).
2. Отмерьте пипеткой 25 мл образца в колбу и проведите титрование по описанной выше методике. При этом учтите, что окраска анализируемого раствора может изменять цвет комплекса крахмала с иодом. Например, красный цвет раствора в сочетании с синей окраской комплекса приведет к тому, что в конце титрования появится фиолетовое окрашивание. Запишите результаты и проведите необходимые расчеты.
Группы представляют полученные результаты, занося их в таблицу в порядке уменьшения содержания витамина С.
Контрольные вопросы:
-
Показались ли вам неожиданными полученные результаты? Почему?
-
Какие еще продукты питания содержат много витамина С?
-
Специалисты в области питания советуют потреблять овощи и фрукты свежими, без длительной тепловой обработки. Почему к этому совету стоит прислушаться?
Выводы
ЛАБОРАТОРНАЯ РАБОТА № 6
Тема: «Определение содержания железа в продуктах».
Цель работы: определить содержания железа в продуктах.
Оборудование: фарфоровый тигель, стакан 50 мл, раствор соляной кислоты, дистиллированная вода, прибор для фильтрования, продукты.
Краткие теоретические сведения
Железо - важный микроэлемент, присутствующий в организме человека, составная часть белков - переносчиков кислорода (гемоглобина и миоглобина). Богаты железом продукты: печень, мясо, зеленые листья овощей, цельное зерно.
Для выполнения этой работы применяется метод визуальной колориметрии, который основан на крайне чувствительной реакции взаимодействия ионов железа(III) с тиоцианат-ионом SCN- , приводящей к появлению ярко-красной окраски:
Fe3+ (водн.) + SCN- (водн.) > Fe(SCN)2+ (водн.) красная окраска
Интенсивность окраски определяется количеством присутствующих в исходном растворе ионов железа (III).
Задание. Определите содержание железа в различных продуктах.
Выполнение работы:
1. Положите в фарфоровый тигель 2,5 г образца продукта и, не закрывая его, прокаливайте на горелке до превращения образца в золу сероватого цвета (следите, чтобы золу не сдуло потоком воздуха). Когда тигель остынет, перенесите всю золу в стакан емкостью не менее 50 мл. Добавьте в стакан 10 мл 2 М HCl и интенсивно перемешайте в течение 1 мин. Затем добавьте 5 мл дистиллированной воды.
2. Соберите прибор для фильтрования. Вылейте содержимое стакана на фильтр и соберите 5 мл фильтрата в пробирку (остальной раствор и фильтр выбросьте).
3. Добавьте к фильтрату 5 мл 0,1 М раствора KSCN. Закройте пробирку пробкой и интенсивно перемешайте встряхиванием. Сравните полученную окраску со стандартной (стандартные растворы готовит учитель заранее) и запишите концентрацию ионов железа в анализируемом растворе.
Каждая группа представляет свои результаты, сравнивает их с результатами других групп. Затем обсуждение можно провести по вопросам:
Контрольные вопросы:
-
Как вы думаете, соответствуют ли полученные вами цифры содержанию железа в исходном образце?
-
Какой из исследованных продуктов питания богаче всего, и какой беднее всего железом?
-
В куске белого пшеничного хлеба 0,8 мг железа. Сколько кусков нужно съедать в день для удовлетворения суточной потребности (для людей в возрасте 11 - 18 лет она составляет 18 мг) в этом микроэлементе?
Выводы
ЛАБОРАТОРНАЯ РАБОТА № 7
Тема: «Рассматривание клеток и тканей в оптический микроскоп».
Цель работы: закрепить умение готовить микропрепараты и рассматривать их под микроскопом, находить особенности строения клеток и тканей различных организмов, сравнивать их между собой.
Оборудование: микроскопы, предметные и покровные стёкла, стаканы с водой, стеклянные палочки, лук, пипетка, йод, разведённые дрожжи, культура сенной палочки, микропрепараты животных и растительных тканей.
Краткие теоретические сведения
Все живые организмы состоят из клеток. Все клетки, кроме бактериальных построены по единому плану. Оболочки клеток впервые увидел в 16 веке Р.Гук, рассматривая срезы растительных и животных тканей под микроскопом. Термин «клетка» утвердился в биологии в 1665 году.
Методы изучения клетки различны:
-
методы оптической и электронной микроскопии. Первый микроскоп был сконструирован Р.Гуком 3 столетия назад, давая увеличение до 200 раз. Световой микроскоп нашего времени увеличивает до 300 раз и более. Однако и такое увеличение недостаточно для того, чтобы увидеть клеточные структуры. В настоящее время применяют электронный микроскоп, увеличивающий предметы в десятки и сотни тысяч раз (до 10 000 000).
Строение микроскопа:
1.Окуляр; 2.Тубус; 3.Объективы; 4.Зеркало; 5.Штатив;
6.Зажим; 7.Столик; 8.Винт

2) химические методы исследования
3) метод клеточных культур на жидких питательных средах
4) метод микрохирургии
5) метод дифференциального центрифугирования.
Основные положения современной клеточной теории:
1. Структура. Клетка - это живая микроскопическая система, состоящая из ядра, цитоплазмы и органоидов.
2. Происхождение клетки. Новые клетки образуются путём деления ранее существующих клеток.
3. Функции клетки. В клетке осуществляются:
-обратимые физиологические процессы (поступление и выделение веществ, раздражимость, движение);
- необратимые химические процессы (развитие).
4. Клетка и организм. Клетка может быть самостоятельным организмом, осуществляющим всю полноту жизненных процессов. Все многоклеточные организмы состоят из клеток. Рост и развитие многоклеточного организма - следствие роста и размножения одной или нескольких исходных клеток.
5. Эволюция клетки. Клеточная организация возникла на заре жизни и прошла длительный путь развития от безъядерных форм к ядерным одноклеточным и многоклеточным организмам.
Выполнение работы:
1. Изучите строение микроскопа по рисунку.
2. Приготовьте микропрепараты кожицы чешуи лука, дрожжевых грибов, бактерии сенной палочки.
3. Рассмотрите под микроскопом микропрепараты.
4.Рассмотрите под микроскопом готовые микропрепараты клеток животных и растительных тканей.
5. Сопоставьте увиденное с изображением объектов на таблицах. Зарисуйте клетки одноклеточных и многоклеточных организмов в тетрадях и обозначьте видимые в световой микроскоп органоиды.
6. Сравните между собой эти клетки. Найдите признаки сходства и признаки различий клеток между собой.
Контрольные вопросы:
1. Каковы причины сходства и различия клеток разных организмов?
2. Какие положения клеточной теории можно подтвердить результатами проведённой работы?
Выводы
ЛАБОРАТОРНАЯ РАБОТА № 8
Тема: «Действие ферментов слюны на крахмал».
Цель работы: изучить действие ферментов слюны на крахмал.
Оборудование: крахмальный клейстер, бинт, йодная вода, слюна, спичка, вата, предметное стекло.
Краткие теоретические сведения
Человек состоит из разнообразных веществ, которые поступают к нам в организм вместе с пищей. Некоторые питательные вещества сразу усваиваются в нашем организме, а некоторые (сложные) вещества, прежде чем попасть в организм должны расщепиться на более мелкие молекулы. Этому способствуют вещества, так называемые ферменты, которые вырабатываются организмом человека и содержатся в пищеварительных соках. Пищеварительные соки вырабатываются всеми пищеварительными железами нашего организма: слюнными, желудочными, кишечными, печенью и поджелудочной. Каждая железа вырабатывает свой пищеварительный секрет, содержащий свои ферменты, которые расщепляют определённые питательные вещества.
Ферменты действуют лишь при определённых условиях: например, фермент слюны птиалин расщепляет крахмал в щелочной среде, а фермент желудочного сока пепсин действует на белки лишь в кислой среде.
Выполнение работы:
1. Смочите в крахмальном клейстере бинт и дайте ему высохнуть.
2. Намотайте на спичку вату, смочите её слюной, а затем на накрахмаленном бинте напишите букву.
3. Расправленный бинт зажмите в руках и подержите его 5 минут, чтобы он нагрелся.
4. Опустите бинт в йодную воду, тщательно его расправив. Участки, где остался крахмал, окрасятся в синий цвет, а места обработанные слюной останутся белыми.
Контрольные вопросы:
1. Объясните результаты опыта.
2. Какие вещества образуются при расщеплении ферментами белков, жиров, углеводов и витаминов в организме человека?
Выводы
Литература
1. Мамонтов С.Г., Сонин Н.И. Биология. Общие закономерности. - Москва, 2006 г. - 287.
2. Машанова О.Г., Евстафьев В.В. Основы цитологии. - Москва, учебно - научный центр «Московский Лицей», 1995 г.
3. Константинов В.М. Общая биология. Москва: Издательский центр «Академия», 2003.
4. Ксенофонтова В.В. Ботаника. - Москва, учебно - научный центр «Московский Лицей», 1995 г.
5. Габриелян О.С. Химия.10, 11 кл. - М., 2000, 2003.
6. Савинкина Е.В., Логинова Г.П. Химия для школ и классов гуманитарного профиля. 10, 11 кл. - М., 2001-2002.
7. Габриелян О. С. Практикум по общей, неорганической и органической химии. / о.с.Габриелян, И. Г. Остроумов, Н.М. Дорофеева. - М.: Издательский центр «Академия», 2009.
8. Габриелян О. С. Химия : учебник для студ. сред. проф. учеб. заведений / О. С. Габриелян, И. Г. Остроумов. - М.: Издательский центр «Академия», 2005.
9. Габриелян О. С. Химический эксперимент в школе. 8 класс: учеб.-метод, пособие / О. С. Габриелян, Н. Н. Рунов, В. И. Толкунов. - М.: Дрофа, 2005.
10. Габриелян О. С. Химический эксперимент в школе. 10 класс: учеб.-метод. пособие / О. С. Габриелян, Л. П. Ватлина. - М. : Дрофа, 2005.
11. Коровин Н. В. Лабораторные работы по химии / Н. В. Коровин, Э. И. Мингулина, Н. Г. Рыжова. - М.: Высшая школа, 1986.


